题目内容
有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)X元素在周期表中的位置______;其相对分子质量最小的气态氢化物常用作______.
(2)工业上制取Y单质常用的方法是(用化学方程式表示)______.
(3)Y离子半径比Z离子的半径______(填“大”或“小”)
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于______(填“吸热”或“放热”)反应,写出反应的化学方程式______.
(5)举出实例说明M的非金属性比X强(用化学方程式表示)______.
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)X元素在周期表中的位置______;其相对分子质量最小的气态氢化物常用作______.
(2)工业上制取Y单质常用的方法是(用化学方程式表示)______.
(3)Y离子半径比Z离子的半径______(填“大”或“小”)
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于______(填“吸热”或“放热”)反应,写出反应的化学方程式______.
(5)举出实例说明M的非金属性比X强(用化学方程式表示)______.
X为构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体,则X为C元素;Y为短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质,则Y为Na元素;Z为与Y同周期,其最高价氧化物的水化物呈两性,则Z为Al元素;M为海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则M为Cl元素,
(1)X为C,位于元素周期表中第二周期ⅣA族,其相对分子质量最小的气态氢化物为甲烷,可作燃料,故答案为:第二周期ⅣA族;燃料;
(2)工业上利用电解法冶炼Na,则化学反应为2NaCl(熔融)
2Na+Cl2↑,故答案为:2NaCl(熔融)
2Na+Cl2↑;
(3)Y为Na,Z为Al,二者的离子具有相同的电子,原子序数大的离子半径小,则Y离子半径比Z离子的半径大,故答案为:大;
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,为铝热反应,反应为2Al+Fe2O3
Al2O3+2Fe,该反应为放热反应,
故答案为:放热;2Al+Fe2O3
Al2O3+2Fe;
(5)由最高价含氧酸的酸性越强,对应非金属的非金属性越强,则Na2CO3+2HClO4=2NaClO4+CO2↑+H2O说明酸性为HClO4>碳酸,非金属性Cl>C,
故答案为:Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
(1)X为C,位于元素周期表中第二周期ⅣA族,其相对分子质量最小的气态氢化物为甲烷,可作燃料,故答案为:第二周期ⅣA族;燃料;
(2)工业上利用电解法冶炼Na,则化学反应为2NaCl(熔融)
| ||
| ||
(3)Y为Na,Z为Al,二者的离子具有相同的电子,原子序数大的离子半径小,则Y离子半径比Z离子的半径大,故答案为:大;
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,为铝热反应,反应为2Al+Fe2O3
| ||
故答案为:放热;2Al+Fe2O3
| ||
(5)由最高价含氧酸的酸性越强,对应非金属的非金属性越强,则Na2CO3+2HClO4=2NaClO4+CO2↑+H2O说明酸性为HClO4>碳酸,非金属性Cl>C,
故答案为:Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.

练习册系列答案
相关题目
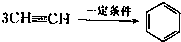 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
