题目内容
【题目】电化学的应用十分广泛,在分析检测、有机合成等领域应用很广,请分析下列几种电化学装置并回答问题:

(1)肼(N2H4)又称联氨,可作燃料电池的燃料。肼燃料电池的原理如图 1 所示,正极上发生反应的电极反应式为___________________________________________;在肼燃料电池使用过程中,负极区的pH_____________(填写“增大”、“减小”或“不变”)。

(2)某模拟“人工树叶”的电化学实验装置如图2所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。该装置工作时,H+从____________(填字母,后同)极区向____________极区迁移,将电能转化为___________能,每生成3molO2,有______________gCO2被还原。
(3)图3中甲装置为C3H8O的燃料电池(电解质溶液为KOH溶液)装置,该同学想在乙装置中实现铁上镀铜,则f处通________________________________,写出电极c上的电极反应式:__________________________________________________________。
【答案】O2+4e-+2H2O=4OH- 减小 b a 化学 88g O2 C3H8O+24OH--18e-=3CO32-+16H2O
【解析】
(1)右侧通入氧气,为正极,正极上发生反应的电极反应式为:O2+4e-+2H2O=4OH-;左边Pt电极上,肼氧化生成氮气,则左边Pt电极为负极,右边Pt电极为正极,肼失去电子发生氧化反应,电极反应式为:N2H4-4e-+4OH-=N2+4H2O,在肼燃料电池使用过程中,负极消耗OH-,负极区的pH减小;
(2)该装置是电解池装置,是将电能转化为化学能,电池总的方程式为:6CO2+8H2O![]() 2C3H8O+9O2,该装置工作时,H+从b极区向a极区迁移,将电能转化为化学能,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有
2C3H8O+9O2,该装置工作时,H+从b极区向a极区迁移,将电能转化为化学能,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有![]() mol的二氧化碳被还原,每生成3molO2,有88gCO2被还原;
mol的二氧化碳被还原,每生成3molO2,有88gCO2被还原;
(3)图3中甲装置为C3H8O的燃料电池(电解质溶液为KOH溶液)装置,该同学想在乙装置中实现铁上镀铜,d为正极,f处通O2,c为负极,负极C3H8O发生氧化反应生成碳酸盐,负极的电极反应式为:C3H8O+24OH--18e-=3CO32-+16H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法不正确的是___
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2__T1(填“>,<或=”)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是__(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=__。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向___反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__mol。
2NH3(g) △H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__mol。
(6)已知:![]() 2NH3(g) △H=-92kJ/mol
2NH3(g) △H=-92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式__。
【题目】一定温度下,在三个体积均为 2.0L 的恒容密闭容器中发生如下反应:A(g)![]() B(g)+C(g)
B(g)+C(g) ![]() H>0。
H>0。
起始物质的量(mol) | 平衡物质的量(mol) | |||||
容器 | 温度(℃) | A(g) | B(g) | C(g) | 达到平衡所需时间(s) | |
Ⅰ | T1 | 0.20 | 0.10 | 0.10 | t1 | |
Ⅱ | T2 | 0.40 | t2 | |||
Ⅲ | T3 | 0.20 | 0.15 | 0.15 | t3 | |
下列说法正确的是( )
A.达到平衡的时间:t3>t1
B.反应达到平衡时,A 的转化率:容器Ⅱ>容器
C.反应达到平衡时,容器 I 中的平均速率为 v(A)=(0.10/t1)mol/(L·s)
D.T1 时,该反应的平衡常数为 0.05
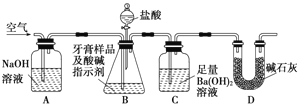
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。实验时按如下步骤操作:

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数。
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_______________________;装置②的作用是_________________________
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为_______________________________________________________。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是____________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是___________(写一种即可)。
(5)某人设想以右图所示装置用电化学原理生产硫酸, 写出通入SO2的电极的电极反应式___________。

【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 实验现象 | 结论 |
实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___①______ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量____②_____ | _____③____ | 白色不溶物可能含有猜测2中不溶物 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 _____④____ |
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________。