题目内容
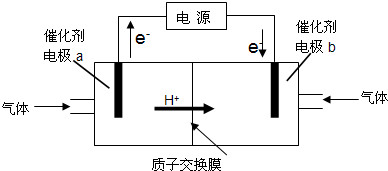
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( )


| A.H+从正极区通过交换膜移向负极区 |
| B.负极的电极反应式为:CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+ |
| C.d导出的是CO2 |
| D.图中b、c分别是O2、甲醇 |
A.原电池工作时,阳离子移向原电池的正极,故A错误;
B.负极甲醇失电子被氧化,电极方程式为CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,故B正确;
C.乙为燃料电池的正极,导入的为空气,氧气在正极被还原生成水,导出的为氮气和水蒸汽,故C错误;
D.图中b、c分别是甲醇、O2,故D错误.
故选B.
B.负极甲醇失电子被氧化,电极方程式为CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,故B正确;
C.乙为燃料电池的正极,导入的为空气,氧气在正极被还原生成水,导出的为氮气和水蒸汽,故C错误;
D.图中b、c分别是甲醇、O2,故D错误.
故选B.

练习册系列答案
相关题目
近年来,各国加速推进燃料电池的研发.燃料电池的燃料有氢气、甲醇等.
(1)通过下列硫--碘循环工艺可制得燃料电池的燃料氢气:
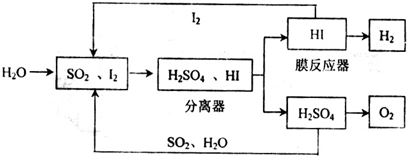
①该循环工艺过程的总反应方程式为 .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l);△H=-283.0kJ?mol-1…①
2CH3OH(1)+3O2(g)→2CO2(g)+4H2O(1);△H=-726.0kJ?mol-1…②
写出二氧化碳与氢气合成甲醇液体的热化学方程式 .
(3)甲醇--空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是
②在稀土金属氧化物的固体电解质中,O2-.的移动方向是 .
(4)已知反应2CH30H?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此 温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小v正 v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH30H)= .
(1)通过下列硫--碘循环工艺可制得燃料电池的燃料氢气:

①该循环工艺过程的总反应方程式为
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l);△H=-283.0kJ?mol-1…①
2CH3OH(1)+3O2(g)→2CO2(g)+4H2O(1);△H=-726.0kJ?mol-1…②
写出二氧化碳与氢气合成甲醇液体的热化学方程式
(3)甲醇--空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是
②在稀土金属氧化物的固体电解质中,O2-.的移动方向是
(4)已知反应2CH30H?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此 温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH30H)=

 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.