题目内容
向某密闭容器中充入1 mol CO 和2 mol H2O(g),发生反应:CO+H2O(g) CO2+H2.当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2+H2.当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
 CO2+H2.当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2+H2.当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是| A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 |
| B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
| C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
| D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
B
由于反应前后体积不变,所以只要最初投入的CO和水蒸气的物质的量之比满足1︰2,平衡即使等效的,因此根据方程式换算后选项ABCD分别是1︰2、1︰1、9︰19、1︰2,所以A和D中平衡时CO的体积分数等于x;B中相当于降低水蒸气浓度,平衡向逆反应方向移动,平衡时CO的体积分数大于x;C中相当于增大水蒸气浓度,平衡向正反应方向移动,平衡时CO的体积分数小于x,答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g) 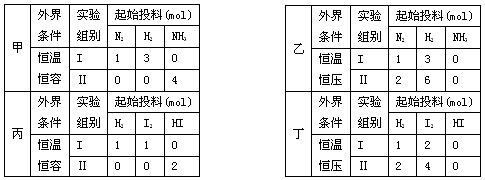
 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )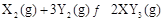

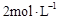
 cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是
cC(g) + dD(g),△H="Q" kJ/mol,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(P)的关系如图所示,据图分析,以下正确的是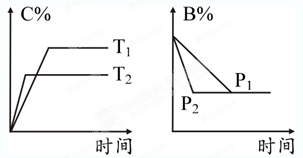
 ?2SO3(g),并达到平衡,在这个过程中,甲始终保持体积不变,乙始终保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
?2SO3(g),并达到平衡,在这个过程中,甲始终保持体积不变,乙始终保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率 与
与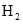 在一定条件下可以生成
在一定条件下可以生成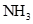 ,同时
,同时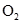 ,氢气和氧气转化成
,氢气和氧气转化成
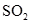 溶于水和
溶于水和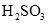 分解
分解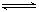 2B(g)和2C(g)
2B(g)和2C(g)  H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是( )
H2(g) + Br2(g)(△H>0)达到平衡时,要使混合气体的颜色变浅,且使Br2的百分含量保持不变,可采取的方法是( )