题目内容
20.下列事实不能用勒沙特列原理解释的是( )| A. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| B. | 实验室可用排饱和食盐水的方法收集氯气 | |
| C. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| D. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、加热会促进MgCl2的水解,蒸干产物不是氯化镁,是氢氧化镁固体,灼烧得到氧化镁,能用勒夏特列原理解释,故A错误;B、氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒夏特列原理解释,故B错误;C、气体的溶解度随温度的升高而减小,随压强的增大而增大,由气体的溶解度随压强的增大而增大,因此常温时打开汽水瓶时,瓶内的压强减小,因此瓶内的二氧化碳会从瓶中溢出,可以用勒夏特列原理解释,故C错误;D、氢气与碘蒸气反应的平衡中,前后气体系数和是相等的,压强对平衡无影响,压缩气体,碘单质的浓度增大,颜色加深,不能用勒夏特利原理解释,故D正确;故选D.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
10.在恒容密闭容器中进行N2+3H2═2NH3反应,起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%.若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是( )
| A. | 40 mol 35% | B. | 20 mol 30% | C. | 20 mol 70% | D. | 10 mol 50% |
11.有下列反应(其中A、B、C、D各代表一种元素)其中还原性强弱顺序为( )
①2A-+B2=2B-+A2
②2A-+C2=2C-+A2
③2B-+C2=2C-+B2
④2C-+D2=2D-+C2.
①2A-+B2=2B-+A2
②2A-+C2=2C-+A2
③2B-+C2=2C-+B2
④2C-+D2=2D-+C2.
| A. | A->B->C->D- | B. | D->C->B->A- | C. | D->B->A->C- | D. | A->C->D->B- |
8.下列说法或表示法正确的是( )
| A. | 需要加热的反应说明不一定是吸热反应 | |
| B. | 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量少 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量等于57.kJ | |
| D. | 1molC完全燃烧放热393.5 kJ,其热化学方程式为:C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol |
5.工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:
(1)此流程的第II步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
从上表可以推断:此反应是放(填“吸”或“放”)热反应.在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为66.7%.
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是AD.
A.2c1=c2=c3 B.2Q1=Q2=Q3 C.α1=α2=α3 D.α1+α2=1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是②③.
①v(CO2)正=v(H2O)逆 ②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)如图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸气的量(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).

(1)此流程的第II步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是②③.
①v(CO2)正=v(H2O)逆 ②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)如图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸气的量(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).

12.下列物质分类中,前者包含后者的是( )
| A. | 非金属氧化物 酸性氧化物 | B. | 化合物 非电解质 | ||
| C. | 溶液 胶体 | D. | 悬浊液 分散系 |
10.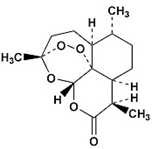 我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )
我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )
 我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )
我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )| A. | 分子中所有碳原子可能处于同一平面上 | |
| B. | 分子中含氧官能团只有酯基 | |
| C. | 青蒿素的化学式是C15H22O5 | |
| D. | 青蒿素属于烃类有机物 |
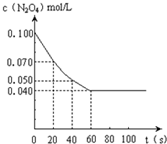 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)