题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
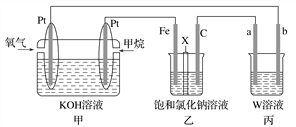
(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
【答案】 阳 CH4+10OH--8e-===CO![]() +7H2O 4.48 AD 2Al+3H2O-6e-===Al2O3 + 6H+
+7H2O 4.48 AD 2Al+3H2O-6e-===Al2O3 + 6H+
【解析】(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,则乙池中铁为阴极,C为阳极;负极上失电子发生氧化反应,电极反应式为:CH4+10 OH--8e-=CO32-+7H2O.
故答案为:阳;CH4-8e-+10 OH-═CO32-+7H2O;
(2)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=![]() ×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48,故答案为:4.48;
(3)电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能;电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应;电解时,溶液中的阳离子发生变化,铜离子浓度逐渐减小,锌离子等浓度逐渐增大;粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近,故答案为AD;
(4)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al+3H2O-6e-=Al2O3+6H+,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-=3H2,故答案为:2Al+3H2O-6e-=Al2O3+6H+。

【题目】I.控制变量法是化学实验中的—种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点—位),分析以下数据,回答下列问题:
序号 | 硫酸的体积 /mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的 时间/s | 生成硫酸锌的质量/g |
① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | 19.3 |
(1)实验①和实验②表明_____对反应速率有影响;研究锌的形状对反应速率的影响时,最好选取实验_______ (填3个实验序号)。
(2)下列数据推断正确的是______________________。
A. t1<70 B.t1>t4 C.m12 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是___________________________________。
(4)根据表中数据计算:硫酸的物质的量浓度是_________________mol/L。
II.己知在 25℃、l0l kPa 下,2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
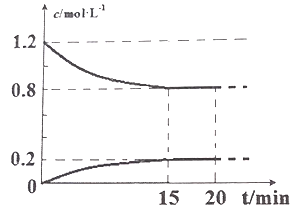
(1) 015min 内,v(CO2) =__________________。
(2)该反应的速率时间图像如下图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图像如下图中右图所示。以下说法正确的是______(填对应字母)。
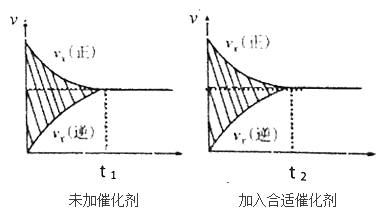
A.a1>a2 B.b12 C.t1>t2
(3) 一定条件下,己知反应NO2(g)+SO2(g) ![]() NO(g)+SO3(g),将NO2
NO(g)+SO3(g),将NO2
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2与SO2的体积比保持不变 d.每消耗lmol SO2的同时生成lmol NO


