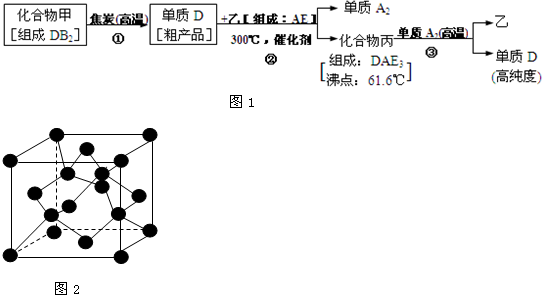
题目内容
五种短周期元素有关数据如表.其中的X是表示元素原子在分子内吸引电子能力的大小,X越大,原子吸引电子的能力越强,其最大值为4.0,最小值是0.7.试回答下列问题:| 元素编号 | A | B | C | D | E |
| X | 3.5 | 3.0 | X3 | 1.5 | 1.5 |
| 主要化合价 | -2 | +7 | +6 | +3 | +2 |
A.3.6B.3.1C.2.5D.1.4
(2)E元素在元素周期表中的位置是 ,B元素单质的电子式为 .
(3)A元素的原子最外层中有 个电子.A、B、C元素形成的单质中,结构微粒间作用力最强的是 (写物质名称).
(4)用一个化学反应可以证明B和C非金属性的强弱,写出该反应的化学方程式: .
【答案】分析:五种短周期元素,A元素的主要化合价为-2价,没有正化合价,故A为O元素,B元素的主要化合价为+7价,故B为Cl元素,C元素的主要化合价为+6,故C为S元素,D元素化合价为+3,处于第ⅢA族,E元素化合价为+2,处于第ⅡA族,二者吸引电子能力相等,故二者不再同一周期,根据对角线原则,D为Al元素,E为Be元素,
(1)同周期自左而右,元素原子吸引电子能力增强,故S元素的X值应介于Al与Cl之间;
(2)E为Be元素,元素原子有2个电子层,最外层电子数为2,据此确定B在周期表中的位置,B的单质为氯气,氯气分子中氯原子之间形成1对共用电子对;
(3)A为O元素,最外层电子数为6,A、B、C元素形成的单质分别为氧气、硫单质、氯气,都属于分子晶体,常温下硫单质为固体,分子间作用力最强;
(4)利用氯气能置换硫单质即可证明氯元素的非金属性强于硫元素.
解答:解:五种短周期元素,A元素的主要化合价为-2价,没有正化合价,故A为O元素,B元素的主要化合价为+7价,故B为Cl元素,C元素的主要化合价为+6,故C为S元素,D元素化合价为+3,处于第ⅢA族,E元素化合价为+2,处于第ⅡA族,二者吸引电子能力相等,故二者不再同一周期,根据对角线原则,D为Al元素,E为Be元素,
(1)同周期自左而右,元素原子吸引电子能力增强,故S元素的X值应介于Al与Cl之间,故选C;
(2)E为Be元素,元素原子有2个电子层,最外层电子数为2,处于周期表中第二周期IIA族,B的单质为氯气,氯气分子中氯原子之间形成1对共用电子对,电子式为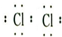 ,故答案为:第二周期IIA族;
,故答案为:第二周期IIA族;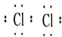 ;
;
(3)A为O元素,最外层电子数为6,A、B、C元素形成的单质分别为氧气、硫单质、氯气,都属于分子晶体,常温下硫单质为固体,分子间作用力最强,
故答案为:6;硫;
(4)利用氯气能置换硫单质即可证明氯元素的非金属性强于硫元素,方程式H2S+C12=2HC1+S可以证明,故答案为:H2S+C12=2HC1+S.
点评:本题考查元素推断、元素性质递变规律、电子式、物质结构与微粒间作用等,难度中等,根据化合价与吸引电子能力判断元素是解题的关键,D、E元素推断是易错点、难点,注意短周期内对角线原则.
(1)同周期自左而右,元素原子吸引电子能力增强,故S元素的X值应介于Al与Cl之间;
(2)E为Be元素,元素原子有2个电子层,最外层电子数为2,据此确定B在周期表中的位置,B的单质为氯气,氯气分子中氯原子之间形成1对共用电子对;
(3)A为O元素,最外层电子数为6,A、B、C元素形成的单质分别为氧气、硫单质、氯气,都属于分子晶体,常温下硫单质为固体,分子间作用力最强;
(4)利用氯气能置换硫单质即可证明氯元素的非金属性强于硫元素.
解答:解:五种短周期元素,A元素的主要化合价为-2价,没有正化合价,故A为O元素,B元素的主要化合价为+7价,故B为Cl元素,C元素的主要化合价为+6,故C为S元素,D元素化合价为+3,处于第ⅢA族,E元素化合价为+2,处于第ⅡA族,二者吸引电子能力相等,故二者不再同一周期,根据对角线原则,D为Al元素,E为Be元素,
(1)同周期自左而右,元素原子吸引电子能力增强,故S元素的X值应介于Al与Cl之间,故选C;
(2)E为Be元素,元素原子有2个电子层,最外层电子数为2,处于周期表中第二周期IIA族,B的单质为氯气,氯气分子中氯原子之间形成1对共用电子对,电子式为
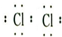 ,故答案为:第二周期IIA族;
,故答案为:第二周期IIA族;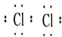 ;
;(3)A为O元素,最外层电子数为6,A、B、C元素形成的单质分别为氧气、硫单质、氯气,都属于分子晶体,常温下硫单质为固体,分子间作用力最强,
故答案为:6;硫;
(4)利用氯气能置换硫单质即可证明氯元素的非金属性强于硫元素,方程式H2S+C12=2HC1+S可以证明,故答案为:H2S+C12=2HC1+S.
点评:本题考查元素推断、元素性质递变规律、电子式、物质结构与微粒间作用等,难度中等,根据化合价与吸引电子能力判断元素是解题的关键,D、E元素推断是易错点、难点,注意短周期内对角线原则.

练习册系列答案
相关题目
(9分)A、B、C、D、E五种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的不同周期邻族元素;D和E的原子序数之和为30。它们两两形成的化合物为甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:(用元素符号作答)
| | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
A: B: C: D: E:
(2)向甲的水溶液中加入MnO2,氧化产物是 。
(3)已知有机物乙的分子为平面结构,碳氢键键角为120°,实验室制取乙的化学方程式为:
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气
 体和难溶物,有关离子方程式是:
体和难溶物,有关离子方程式是: (9分)A、B、C、D、E五种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的不同周期邻族元素;D和E的原子序数之和为30。它们两两形成的化合物为甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:(用元素符号作答)
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
(1)写出A~E的元素符号
A: B: C: D: E:
(2)向甲的水溶液中加入MnO2,氧化产物是 。
(3)已知有机物乙的分子为平面结构,碳氢键键角为120°,实验室制取乙的化学方程式为:
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式是:
 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:

 NH3?H2O+H+
NH3?H2O+H+