题目内容
现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH,且已知:CO2+3H2O+2 ====2Al(OH)3↓+
====2Al(OH)3↓+ 。
。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是________(填编号)。
(2)当上述物质的量浓度均为0.1mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大的是________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是________(填编号)。
(4)将上述①②③④这四种电解质溶液混合,发生反应的离子方程式为______________。
 ====2Al(OH)3↓+
====2Al(OH)3↓+ 。
。(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是________(填编号)。
(2)当上述物质的量浓度均为0.1mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大的是________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是________(填编号)。
(4)将上述①②③④这四种电解质溶液混合,发生反应的离子方程式为______________。
(1)④>②>①>③>⑤(2)⑤
(3)③④⑤
(4)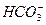 +
+ +H2O====Al(OH)3↓+
+H2O====Al(OH)3↓+
(3)③④⑤
(4)
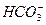 +
+ +H2O====Al(OH)3↓+
+H2O====Al(OH)3↓+
(1)在题给五种电解质中,NaOH是强碱,可完全电离,前四种都是弱酸强碱盐,在溶液中可水解,根据盐类的水解规律,谁弱谁水解,越弱越水解,可得知同物质的量浓度的四种盐水解后,其碱性即pH:③>①>②>④。因此当五种溶液的pH相同时,其物质的量浓度:④>②>①>③>⑤。
(2)因为NaOH完全电离,稀释10n倍,pH就减少n;其余四种均是盐溶液,稀释可以促进盐的水解,稀释10n倍,pH的减少小于n。所以pH变化最大的是⑤。
(3)AlCl3是强酸弱碱盐,也可水解,水解后溶液显酸性。在上述五种电解质溶液中分别加入AlCl3溶液后,只有Na2CO3和NaHCO3溶液中发生双水解有CO2气体放出,其余的无气体产生。
(4)由题给信息知,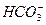 的酸性比Al(OH)3的酸性强,因此可发生反应
的酸性比Al(OH)3的酸性强,因此可发生反应
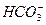 +
+ +H2O====Al(OH)3↓+
+H2O====Al(OH)3↓+ 。
。
(2)因为NaOH完全电离,稀释10n倍,pH就减少n;其余四种均是盐溶液,稀释可以促进盐的水解,稀释10n倍,pH的减少小于n。所以pH变化最大的是⑤。
(3)AlCl3是强酸弱碱盐,也可水解,水解后溶液显酸性。在上述五种电解质溶液中分别加入AlCl3溶液后,只有Na2CO3和NaHCO3溶液中发生双水解有CO2气体放出,其余的无气体产生。
(4)由题给信息知,
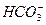 的酸性比Al(OH)3的酸性强,因此可发生反应
的酸性比Al(OH)3的酸性强,因此可发生反应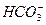 +
+ +H2O====Al(OH)3↓+
+H2O====Al(OH)3↓+ 。
。
练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
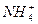 )分别为a、b、c(单位为mol·L-1),则下列判断正确的是( )
)分别为a、b、c(单位为mol·L-1),则下列判断正确的是( ) )+ c(HCO
)+ c(HCO )+ c(H2CO3)
)+ c(H2CO3) )> c(OH-)> c(H+)
)> c(OH-)> c(H+)

