题目内容
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)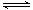 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g)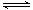 CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g)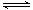 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
A.加入某物质作催化剂 B.加入一定量CO C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率
为 ;
若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g)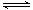 CH3OCH3(g)+CO2(g)的△H= 。
CH3OCH3(g)+CO2(g)的△H= 。
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如上图所示。b电极是 极,写出b电极上发生的电极反应式 。

(10分)(1)BC (2分)
(2)0.1 mol/(L.min) (1分) a=5 (2分)
(3) -246.1kJ·mol-1 (2分)
(4)正 (1分) O2+4e-+4H+==2H2O(2分)

关于物质分类的正确组合是( )
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | MgCl2 | CO2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4Ba(NO3)2、AgNO3和CuSO4,将该混合物进行如下实验,根据所给实验现象完成表格(对于可能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许固体放入水中得到无色溶液和白色沉淀。
| 肯定存在的物质 | 肯定不存在的物质 | 理由 |
(2)取溶液进行焰色反应,火焰呈黄色。
| 肯定存在的物质 | 肯定不存在的物质 | 理由 |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
| 肯定存在的物质 | 肯定不存在的物质 | 理由 |
(4)通过上述实验仍无法确定的物质是__________________。
