题目内容
有关钴和铁化合物的性质见下表:
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl═CoCl2+H2↑工艺流程如下:
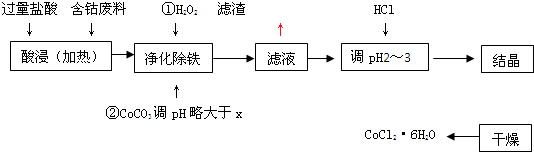
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式______
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全.试计算室温下,Fe(OH)3沉淀完全时,则x=______.
(3)②步中用CoCO3调pH略大于x的原因是______.
(4)滤液中所含溶质有______,______.
(5)为了防止CoCl2?6H2O脱水,“干燥”时宜采用的方法或操作是______,______.
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |

试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式______
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全.试计算室温下,Fe(OH)3沉淀完全时,则x=______.
(3)②步中用CoCO3调pH略大于x的原因是______.
(4)滤液中所含溶质有______,______.
(5)为了防止CoCl2?6H2O脱水,“干燥”时宜采用的方法或操作是______,______.
(1))“净化除铁”中,加入CoCO3(难溶),CoCO3属于碳酸盐,可与酸反应,CoCO3+2H+=Co2++H2O+CO2↑,通过此反应降低溶液的酸性,调溶液的pH,
故答案为:CoCO3+2H+=Co2++H2O+CO2↑;
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全,Ksp[Fe(OH)3]=1.0×10-35=c(Fe3+)×c3(OH-)=1.0×10-5mol?L-1×c3(OH-),所以c(OH-)=10-10mol?L-1,c(H+)=
mol?L-1=10-4mol?L-1,PH=-lgc(H+)=-lg10-4=4;
故答案为:4;
(3)根据(2)分析可知,为了使Fe3+完全沉淀,pH应略大于4,故答案为:使Fe3+完全沉淀;
(4)除去Fe3+,滤液中主要含有NaCl、CoCl2、以及极少量的HCl,故答案为:CoCl2;NaCl;
(5)因CoCl2?6H2O在110°C~120°C时脱水变成蓝色无水氯化钴,所以不能用高温烘干,为了防止CoCl2?6H2O脱水,“干燥”时宜采用的方法或操作是减压或温度低于110℃或在HCl气流中加热,故答案为:减压或温度低于110℃;或在HCl气流中加热.
故答案为:CoCO3+2H+=Co2++H2O+CO2↑;
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全,Ksp[Fe(OH)3]=1.0×10-35=c(Fe3+)×c3(OH-)=1.0×10-5mol?L-1×c3(OH-),所以c(OH-)=10-10mol?L-1,c(H+)=
| 10-14 |
| 10-10 |
故答案为:4;
(3)根据(2)分析可知,为了使Fe3+完全沉淀,pH应略大于4,故答案为:使Fe3+完全沉淀;
(4)除去Fe3+,滤液中主要含有NaCl、CoCl2、以及极少量的HCl,故答案为:CoCl2;NaCl;
(5)因CoCl2?6H2O在110°C~120°C时脱水变成蓝色无水氯化钴,所以不能用高温烘干,为了防止CoCl2?6H2O脱水,“干燥”时宜采用的方法或操作是减压或温度低于110℃或在HCl气流中加热,故答案为:减压或温度低于110℃;或在HCl气流中加热.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目