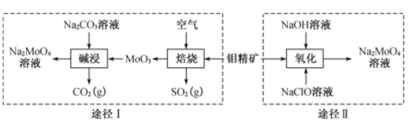
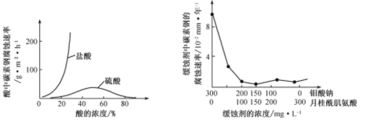
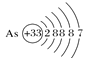
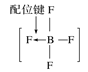
题目内容
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液。
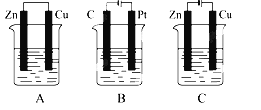
(1)A、B、C三个装置中属于原电池的是________(填标号)。
(2)A池中Zn极发生______反应(填“氧化”或“还原”);Cu是________极,该极的电极反应式为______________________。
(3)B池中Pt是____极,该极的电极反应为________, B池中总反应的化学方程式为________________________________,溶液中阴离子向________(C、Pt)极移动。
(4)C池中Cu极的电极反应为________________,反应过程中,溶液浓度________(填“变大”“变小”或“不变”)。
【答案】A 氧化 正 Cu2++2e-=Cu 阳 2Cl--2e-= Cl2↑ CuCl2![]() Cu+Cl2↑ Pt Cu_2e-= Cu2+ 不变
Cu+Cl2↑ Pt Cu_2e-= Cu2+ 不变
【解析】
(1)把化学能转化为电能的装置是原电池;把电能转化为化学能的装置是电解池,所以电解池有外接电源;
(2)该装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,锌和氯化铜发生置换反应;
(3)电解池阴极上得电子发生还原反应,惰性材料作电极时,溶液中阴阳离子放电,阳极上氯离子放电,阴极上铜离子放电生成铜;
(4)连接原电池正极的是阳极,连接原电池负极的是阴极,阳极是活泼电极,电解池工作时,阳极材料失电子而不是溶液中阴离子失电子,根据阴阳极上发生的反应确定溶液中铜离子浓度是否变化。
(1)A装置是将化学能转化为电能的装置,为原电池;BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池,故选A;
(2)该装置是原电池,较活泼的金属锌作负极,铜作正极,锌和铜离子发生氧化还原反应生成锌离子和铜单质,所以A池中Zn极发生失电子的氧化反应;Cu是正极,正极上铜离了得电子产生铜单质,反应的电极反应式为Cu2++2e-=Cu;
(3)B池中Pt连接电源的正极,是电解池的阳极,阳极上氯离子失电子产生氯气,电极反应为2Cl--2e-= Cl2↑, 阴极上铜离子得电子产生铜单质,B池中总反应的化学方程式为CuCl2![]() Cu+Cl2↑,溶液中阴离子向阳极,即Pt极移动;
Cu+Cl2↑,溶液中阴离子向阳极,即Pt极移动;
(4)C池中Cu极电源的正极,为阳极,阳极上铜失电子产生铜离子,电极反应为Cu_2e-= Cu2+,阴极上溶液中的铜离子得电子产生铜单质,为在锌上镀铜,反应过程中,溶液浓度不变。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。下列说法正确的是
试管 | ① | ② | ③ | ④ |
实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉淀产生 | 品红溶液褪色 |

A.②中白色沉淀是BaSO3
B.①中可能有部分浓硫酸挥发了
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变