题目内容
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是 ( )
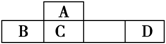
A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应
D.A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性

A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应
D.A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性
C
试题分析:D形成的两种氧化物都是大气污染物,判断D为S元素,则A、B、C分别是C、Al、Si元素。A、A的非金属性强于C,所以简单氢化物的热稳定性:C<A,错误;B、D的非金属性强于C,所以最高价氧化物对应水化物的酸性:D>C,错误;C、B的最高价氧化物的水化物是Al(OH)3,D的最高价氧化物的水化物H2SO4,二者发生中和反应,正确;D、D的最高价含氧酸的钠盐水溶液不显碱性,而是中性,错误,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 <Mg
<Mg <Al
<Al <O
<O
 >Na
>Na