题目内容
【题目】下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
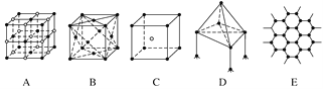
(1)其中代表金刚石的是(填编号字母,下同)____,其中每个碳原子与______个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(3)代表干冰的是________,它属于________晶体,每个CO2分子与______个CO2分子紧邻。
【答案】D 4 原子 A 12 B 分子 12
【解析】
根据不同物质晶体的结构特点来辨别图形所代表的物质,据此答题。
(1)金刚石是原子晶体,金刚石的基本单元是正四面体,则代表金刚石的是选项D,金刚石中每个碳原子与4个碳原子最接近且距离相等,故答案为:D,4,原子。
(2)氯化钠是离子晶体,则代表氯化钠的是选项A,其构成微粒是阴阳离子,NaCl晶胞是简单的立方单元,阴阳离子间通过离子键结合,氯离子和钠离子的配位数都是6,每个钠离子周围有6个氯离子,每个钠离子周围与它最接近且距离相等的钠离子数=3×8×![]() =12,故答案为:A,12。
=12,故答案为:A,12。
(3)干冰是分子晶体,则代表代表干冰的是选项B,每个CO2分子与(3×8)÷2=12个CO2分子紧邻,故答案为:B,分子,12。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
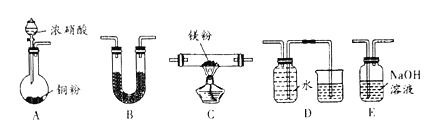
小学生10分钟应用题系列答案【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
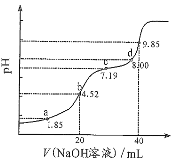
已知:1.饱和NaClO溶液pH为1l;2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HCO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_______,装置A中发生反应的离子方程式_____。
②C瓶溶液中的溶质是NaCl、______(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因_______。
(2)测定C瓶溶液中NaClO含量(单位:g)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为______。
②通常选用______作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_______g/L(保留2位小数)