题目内容
用Pt电极电解浓度为17%的饱和硝酸银溶液,当金属银完全析出时,阳极上放出5.6 L气体(标准状况),电解后溶液的密度为1.038 g·cm-3。试计算:
(1)电解前原硝酸银溶液的总质量是多少?电解析出的银多少克?
(2)电解前硝酸银的溶解度是多少?
(3)电解后所得溶液的质量分数和物质的量浓度各为多少?
(1)电解前原硝酸银溶液的总质量是多少?电解析出的银多少克?
(2)电解前硝酸银的溶解度是多少?
(3)电解后所得溶液的质量分数和物质的量浓度各为多少?
(1)1000 g 108 g (2)20.48 g (3)7.1% 1.17 mol·L-1
(1)由4AgNO3+2H2O 4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。
4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。
电解前硝酸银溶液的质量设为x。
 =17%,x="1000" g
=17%,x="1000" g
(2)AgNO3溶液的溶解度为= ×100 g="20.48" g
×100 g="20.48" g
(3)根据上述关系式可知电解生成HNO3 1 mol。
w(HNO3)= ×100%=7.1%
×100%=7.1%
c(HNO3)= ="1.17" mol·L-1
="1.17" mol·L-1
 4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。
4Ag+4HNO3+O2↑,可知生成的5.6 L气体是O2,其物质的量为0.25 mol,质量为8 g,则析出银:0.25 mol×4×108 g·mol-1="108" g。电解前硝酸银溶液的质量设为x。
 =17%,x="1000" g
=17%,x="1000" g(2)AgNO3溶液的溶解度为=
 ×100 g="20.48" g
×100 g="20.48" g(3)根据上述关系式可知电解生成HNO3 1 mol。
w(HNO3)=
 ×100%=7.1%
×100%=7.1%c(HNO3)=
 ="1.17" mol·L-1
="1.17" mol·L-1
练习册系列答案
相关题目
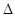 H=-393.5kJ/mol
H=-393.5kJ/mol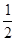 Y2(g)=WY2(g);
Y2(g)=WY2(g);
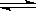 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。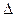 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。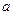 的代数式表示NH3·H2O的电离常数Kb= 。
的代数式表示NH3·H2O的电离常数Kb= 。
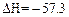 kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ
kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ