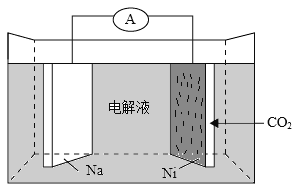
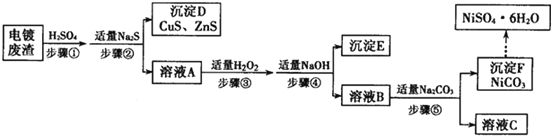
题目内容
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_________________。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式________________________________。
(2)由A、B两种元素组成的18电子微粒的分子式为____________________。
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
【答案】第三周期ⅢA族 Al(OH)3 + OH- ==AlO2-+ 2H2O C2H6 BaO2+H2SO4== BaSO4 ↓+H2O2 56L
【解析】
A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-= AlO2-+2H2O;
答案为第三周期第ⅢA族;Al(OH)3+OH-= AlO2-+2H2O。
(2)由H、C两种元素组成的18电子微粒,因为C有6个电子,所以C不超过3个,若C为1个,根据18电子数则H为12个,不合题意;若C为2个,则H为6个,符合题意,则分子式为C2H6;
答案为C2H6。
(3)A2W2为H2O2,是二元弱酸,常用硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2;
答案为BaO2+H2SO4=BaSO4↓+H2O2;
(4)NaH+H2O=NaOH + H2↑
![]()
2NaOH+2Al+2H2O=2NaAlO2+3H2↑,![]()
![]()
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L;
答案为56L。![]()

 阅读快车系列答案
阅读快车系列答案【题目】处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理犬气污染物N2O所发生的反应为:N2O(g)+CO(g)![]() CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量kJ·mol-1 | 475.5 | 283 | 0 | 393.5 |
①ΔH=______kJ·mol-1;改变下列“量”,一定会引起ΔH发生变化的是____填代号)
A.反应物浓度 B.催化剂 C.化学计量数
②有人提出上述反应可以用Fe作催化剂。其总反应分两步进行:第一步:Fe+N2O=FeO+N2,第二步:______(写化学方程式)。第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应活化能____第一步反应活化能(填“大于”、“小于”或等于”)。
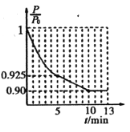
(2)在实验室,釆用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5(g)+5CO(g)![]() 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。

①相对曲线a,曲线b仅改变一个条件,改变的条件可能是______。
②在此温度下,该可逆反应的平衡常数K=_____(用含x的代数式表示)。
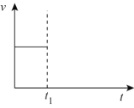
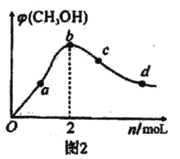
(3)工业上,用CO和H2合成CH3OH。在1L恒容密闭容器中充入1molCO(g)和nmolH2,在250℃发生反应:CO(g)+2H2(g)![]() CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___。
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___。
(4)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:______。