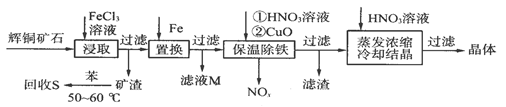
题目内容
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
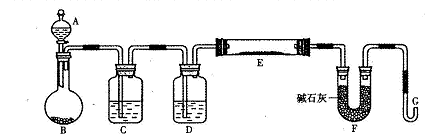
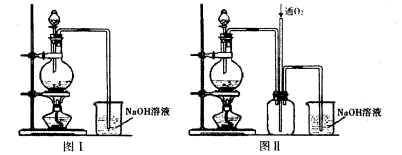
按下图装置(固定装置已略去)进行实验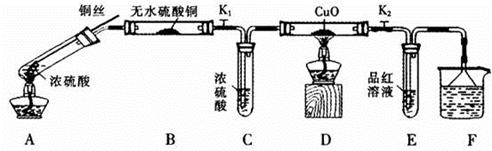
(1)A中反应的化学方程式为:
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。
仅由上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 。 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
(14分)(1) Cu +2H2SO4(浓)= CuSO4 + SO2+ 2H2O (2分)
(2)NaOH溶液(或KMnO4溶液等) (2分)
(3)D装置中黑色固体颜色无变化,E中溶液褪色 (2分)
(4)将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌 (2分)
(5)使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝 (2分)
(6)abd
(7)(64bV/a)% (2分)
解析试题分析:⑴铜与浓硫酸的反应Cu +2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O,故答案为:Cu +2H2SO4(浓)
CuSO4 + SO2↑+ 2H2O,故答案为:Cu +2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O;⑵F为尾气吸收装置,通常用NaOH溶液或KMnO4溶液,答案:NaOH溶液(或KMnO4溶液等);⑶如果有H2产生,则D中固体变红,E溶液不褪色,所以如产生SO2,则D装置中黑色固体颜色无变化,E中溶液褪色,证明浓硫酸中硫元素的氧化性强于氢元素。答案:D装置中黑色固体颜色无变化,E中溶液褪色;⑷含有Cu2+ 的稀溶液的颜色为蓝色,所需的操作是将含浓硫酸的混合溶液稀释。答案:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌。⑸控制反应条件,使反应不产生SO2,进行对比实验。答案:使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝。⑹a正确,反应中有黑色的固体产生,生成物不止一种,反应不止一个;b从资料1的表中看出浓硫酸浓度在16mol/L以下时,加热后黑色的固体可能消失,b正确;c反应只要是浓硫酸,资料中没有强调硫酸浓度≥15 mol·L-1,c不正确;d从表中看出.硫酸浓度越大,黑色固体出现的温度越低,黑色物质越快出现、消失所需温度越高,甚至不消失,d正确,选a b d.。
CuSO4 + SO2↑+ 2H2O;⑵F为尾气吸收装置,通常用NaOH溶液或KMnO4溶液,答案:NaOH溶液(或KMnO4溶液等);⑶如果有H2产生,则D中固体变红,E溶液不褪色,所以如产生SO2,则D装置中黑色固体颜色无变化,E中溶液褪色,证明浓硫酸中硫元素的氧化性强于氢元素。答案:D装置中黑色固体颜色无变化,E中溶液褪色;⑷含有Cu2+ 的稀溶液的颜色为蓝色,所需的操作是将含浓硫酸的混合溶液稀释。答案:将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌。⑸控制反应条件,使反应不产生SO2,进行对比实验。答案:使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝。⑹a正确,反应中有黑色的固体产生,生成物不止一种,反应不止一个;b从资料1的表中看出浓硫酸浓度在16mol/L以下时,加热后黑色的固体可能消失,b正确;c反应只要是浓硫酸,资料中没有强调硫酸浓度≥15 mol·L-1,c不正确;d从表中看出.硫酸浓度越大,黑色固体出现的温度越低,黑色物质越快出现、消失所需温度越高,甚至不消失,d正确,选a b d.。
⑺ 根据方程式2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-,
得关系式Cu2+ ― S2O32―
c×25 bv
n(Cu2+ )=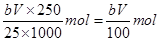
则硫酸铜的产率为:实际产量÷理论产量×100%=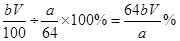
考点:元素化合物知识、基本实验实验、化学反应原理、氧化还原反应、化学计算等综合性较强。中等难度。

 名校课堂系列答案
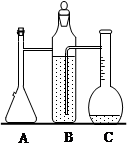
名校课堂系列答案实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
| 步骤3: | 若 则 ; 否则 。 |
医疗上给病人输液补充能量,常用的糖是
| A.葡萄糖 | B.麦芽糖 | C.淀粉 | D.纤维素 |