题目内容
如右图所示,当关闭阀门K时,向甲中充入2molSO2和1molO2,在800℃时发生反应:
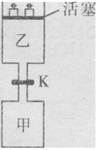
 .1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
.1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
A.在800℃,若向甲的平衡体系中,再充入lmolS03气,达到薪平衡时,SO3的体积分数增大
B.800℃时,乙中反应达到平衡状态时,其气体体积小于1.125L
C若打开阀门K,新的平衡混合气中SO3的体积分数比打开K前甲、乙中的都大
D.800℃时,乙中反应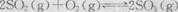 的平衡常数为24
的平衡常数为24

 .1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
.1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )A.在800℃,若向甲的平衡体系中,再充入lmolS03气,达到薪平衡时,SO3的体积分数增大
B.800℃时,乙中反应达到平衡状态时,其气体体积小于1.125L
C若打开阀门K,新的平衡混合气中SO3的体积分数比打开K前甲、乙中的都大
D.800℃时,乙中反应
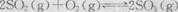 的平衡常数为24
的平衡常数为24A
勒沙特列原理告诉我们,改变一个条件,平衡向减弱这种改变的方向移动,但不能抵消这种改变,A中加入三氧化硫后平衡虽然逆向移动,但三氧化硫的体积分数一定是增加的。B,不用具体计算也可知达到平衡时气体体积一定小于1L;C,达到新平衡时,SO3的体积分数与打开K前乙中的相同;甲中通过计算知800℃时平衡常数为12,则乙中平衡常数也是12,D错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 xC(气)+2D(气)。经过5 min反应达到平衡,生成1mol D,经测定知C的平均反应速率为0.1mol/L(L·min)。与此有关的以下叙述中错误的是
xC(气)+2D(气)。经过5 min反应达到平衡,生成1mol D,经测定知C的平均反应速率为0.1mol/L(L·min)。与此有关的以下叙述中错误的是 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示); 2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。
2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。  CO2(g)+H2(g),且平衡常数K=1,若用2mol CO和10mol H2O(g)相互混合并加热到800℃,则CO的转化率为多少?
CO2(g)+H2(g),且平衡常数K=1,若用2mol CO和10mol H2O(g)相互混合并加热到800℃,则CO的转化率为多少?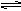 2C(g),当反应达化学平均时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是( )
2C(g),当反应达化学平均时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是( ) 2Z(g)
2Z(g)