题目内容
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期元素的第一电离能随原子序数的增大,总趋势逐渐增大。镓![]() 的基态电子排布式是_____,
的基态电子排布式是_____,![]() 的第一电离能明显低于
的第一电离能明显低于![]() ,原因是______。
,原因是______。
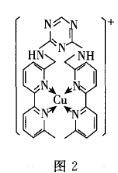
(2)多酚氧化酶与植物的抗病性有关。配合物![]() 是多酚氧化酶的模型配合物。
是多酚氧化酶的模型配合物。
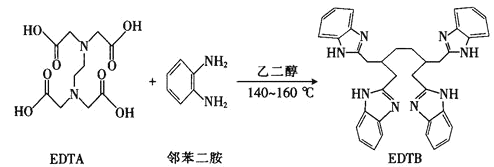
![]() 一个EDTA分子中
一个EDTA分子中![]() 键的数目为______________。
键的数目为______________。
![]() 分子中所含元素的电负性由小到大的顺序为______________________。
分子中所含元素的电负性由小到大的顺序为______________________。
![]() 与
与![]() 互为等电子体的一种阴离子为___________________。
互为等电子体的一种阴离子为___________________。
![]() 配离子
配离子![]() 中的配位原子是__________________。
中的配位原子是__________________。
(3)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,再向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是____________________________________________![]() 用相关的离子方程式和简单的文字说明加以解释
用相关的离子方程式和简单的文字说明加以解释![]() 。
。
(4)![]() 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠![]() ,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。
,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。

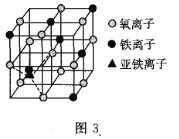
(5)钒的某种氧化物晶胞结构如图2所示。该氧化物的化学式为_____________,若它的晶胞参数为![]() ,则晶胞的密度为__________
,则晶胞的密度为__________![]() 写计算式
写计算式![]() 。
。

【答案】![]()
![]() 的4s能级处于全充满状态,较稳定
的4s能级处于全充满状态,较稳定 ![]()
![]()
![]() 或
或![]()
![]() 蓝色沉淀与氨水可发生如下反应:
蓝色沉淀与氨水可发生如下反应:![]() ,生成的
,生成的![]() 在极性较小的乙醇中溶解度较小而析出
在极性较小的乙醇中溶解度较小而析出 ![]()
![]()
![]()

【解析】
(1)镓![]() 核外有31个电子,根据能量最低原理写基态原子的电子排布式;原子轨道处于全满、半满、全空时能量最低;
核外有31个电子,根据能量最低原理写基态原子的电子排布式;原子轨道处于全满、半满、全空时能量最低;
(2)![]() 单键全为
单键全为![]() 键,双键中有1个
键,双键中有1个![]() 键和1个
键和1个![]() 键;
键;
![]() ;
;
![]() 原子数相同、价电子数也相同的分子或离子为等电子体;
原子数相同、价电子数也相同的分子或离子为等电子体;
![]() 配离子
配离子![]() 中的配位原子提供孤电子对。
中的配位原子提供孤电子对。
(3)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色氢氧化铜沉淀,继续加入氨水氢氧化铜沉淀形成四氨合铜离子而溶解,得到深蓝色透明溶液,再向该溶液中加入乙醇,生成的![]() 在极性较小的乙醇中溶解度较小而析出。
在极性较小的乙醇中溶解度较小而析出。
![]() 中,V形成4个
中,V形成4个![]() 键,孤电子对数为
键,孤电子对数为![]() ;由链状结构可知每个V与3个O形成阴离子,且V的化合价为
;由链状结构可知每个V与3个O形成阴离子,且V的化合价为![]() 价;
价;
(5)根据“均摊原则”计算晶胞中的原子数;![]() 晶胞的摩尔质量÷(晶胞的体积×
晶胞的摩尔质量÷(晶胞的体积×![]() )。
)。
![]() 镓
镓![]() 核外有31个电子,根据能量最低原理,镓
核外有31个电子,根据能量最低原理,镓![]() 的基态电子排布式为
的基态电子排布式为![]() ;因为
;因为![]() 的基态电子排布式为
的基态电子排布式为![]() ,4s能级处于全充满状态,较稳定,所以
,4s能级处于全充满状态,较稳定,所以![]() 的第一电离能明显低于
的第一电离能明显低于![]() ;
;
![]() 由EDTA的结构可知,分子中含有4个C=O双键,所以一个EDTA分子中
由EDTA的结构可知,分子中含有4个C=O双键,所以一个EDTA分子中![]() 键的数目为4;
键的数目为4;
![]() 分子中所含元素有H、C和N,非金属性越强电负性越大,电负性由小到大的顺序为
分子中所含元素有H、C和N,非金属性越强电负性越大,电负性由小到大的顺序为![]() ;
;
![]() 等电子体指具有相同的原子数,价电子总数相同的微粒,
等电子体指具有相同的原子数,价电子总数相同的微粒,![]() 的价电子数为24,其等电子体为
的价电子数为24,其等电子体为![]() 或
或![]() ;
;
![]() 分子中只有N含有孤对电子,配离子
分子中只有N含有孤对电子,配离子![]() 中的配位原子是N;
中的配位原子是N;
![]() 蓝色氢氧化铜沉淀与氨水可发生如下反应:
蓝色氢氧化铜沉淀与氨水可发生如下反应:![]() ,生成的
,生成的![]() 在极性较小的乙醇中溶解度较小而析出;
在极性较小的乙醇中溶解度较小而析出;
![]() 中,V形成4个
中,V形成4个![]() 键,孤电子对数为
键,孤电子对数为![]() ,V的杂化轨道为
,V的杂化轨道为![]() ;由链状结构可知每个V与3个O形成阴离子,且V的化合价为
;由链状结构可知每个V与3个O形成阴离子,且V的化合价为![]() 价,则形成的化合物化学式为
价,则形成的化合物化学式为![]() ;
;
![]() 由图2知:V原子个数为
由图2知:V原子个数为![]() ,O原子个数为:
,O原子个数为:![]() ,该氧化物的化学式为
,该氧化物的化学式为![]() ;晶胞的密度
;晶胞的密度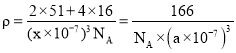 。
。