题目内容
【题目】(15分)某探究小组以硫酸和铜为原料设计如下四种制备硫酸铜晶体的路线:

请回答下列有关问题:
(1)甲方案中第一步发生反应的化学方程式为___________________。
(2)甲、乙、丙方案中,_____方案更合理,原因是________________。
(3)采用乙方案,用废铜、废酸(含HNO3、H2SO4)为主要原料制备硫酸铜晶体,某含有c(HNO3)=2molL-1,c(H2SO4)=4molL-1的废酸混合液100mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4 5H2O)的质量为___________。
(4)丙方案中灼烧时,应在________中进行(填仪器名称),该实验中的后续操作指的是____________。
(5)丁方案中X可以是试剂,也可以是反应条件:
①若X为试剂,该反应的化学方程式为__________________。
②若X为反应条件,即通电,在虚线框中画出该实验设计图。

【答案】(1)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O(2分)
CuSO4+SO2↑+2H2O(2分)
(2)丙(l分) 丙方案中硫酸的利用率高且无污染空气的气体产生(2分,或“甲方案有SO2气体产生,污染空气,乙方案有氮的氧化物生成;污染空气”或“甲、乙方案均有污染空气的气体产生”)
(3)75g(2分)(4)坩埚(l分);蒸发浓缩、冷却结晶、过滤(3分)
(5)①Cu+H2SO4(稀)+H2O2=CuSO4+2H2O (2分) ②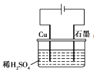 (2分)
(2分)
【解析】
试题分析:(1)甲方案中Cu与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)甲中生成有毒气体二氧化硫,乙中操作复杂且生成有毒气体,只有丙中总反应为2Cu+O2+2H2SO4═2CuSO4+2H2O,不生成有毒气体,则丙方案合理;
(3)n(HNO3)=0.2mol,n(H2SO4)=0.4mol,则n(H+)=1.0mol,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,硝酸完全反应生成的铜离子为0.3mol,由Cu~CuSO45H2O可知,CuSO45H2O的质量为0.3mol×250g/mol=75g;
(4)高温灼烧固体应在坩埚中进行,因此仪器应为坩埚;溶液通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铜晶体;
(5)①铜与稀硫酸不反应,若X为试剂,则X应该具有氧化性,因此X是双氧水,该反应的化学方程式为Cu+H2SO4(稀)+H2O2=CuSO4+2H2O
②若X为反应条件,即通电,这说明该装置是电解池,铜与电源的正极相连,作阳极,电解质是硫酸,阴极可以是石墨,装置如图所示(见答案)。

 名师点拨卷系列答案
名师点拨卷系列答案