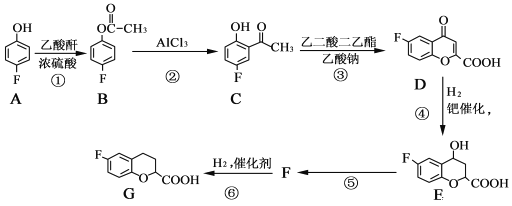
题目内容
【题目】下列关于胶体的说法正确的是( )
A. 依据丁达尔效应可将分散系分为溶液、胶体与浊液
B. 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C. Na+、K+、SO42-、Br-能在Fe(OH)3胶体中大量共存
D. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
【答案】B
【解析】
A.分散系按照分散质粒子直径大小分为:溶液、胶体和浊液,分散质粒度大于100nm的为浊液,介于1nm~100nm为胶体,小于1nm的为溶液,故A错误;
B.向污水中投放明矾,生成能凝聚悬浮物的氢氧化铝胶体,反应的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+,故B正确;
C.胶体中加入电解质,胶体能够发生聚沉,不能大量共存,故C错误;
D.氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,故D错误;
故选B。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式______
(3)某同学取步骤③所得溶液于试管中,滴加足量盐酸、BaCl2溶液产生白色沉淀,他认为通过测定产生的白色沉淀的质量即可求出实验所用Na2CS3的量,你是否同意他的观点并说明理由______。
实验2:测定Na2CS3溶液的浓度

按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(4)盛放无水CaCl2的仪器的名称是______,B中发生反应的离子方程式是______。
(5)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是______。
(6)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为______。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值______(填“偏高”、“偏低”或“无影响”)。
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |