题目内容
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)能判断反应达到平衡状态的依据是__________(填字母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F.CO、H2、CH3OH的速率之比为1:2:1
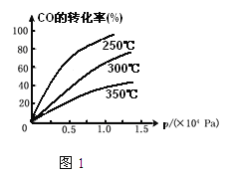
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H_______0(填“>”或“<”)
(3)一定温度下,将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为_______________。
②若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,判断平衡移动的方向是_______________(“正向移动”、“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的![]() ,与原平衡相比,下列有关说法正确的是_____________(填字母)。
,与原平衡相比,下列有关说法正确的是_____________(填字母)。
A.H2的浓度减小; B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加; D.重新平衡时,![]() 增大;
增大;
【答案】CD < ![]() 正向移动 BC
正向移动 BC
【解析】
本题考查化学平衡的状态的判断依据、化学平衡常数的计算,反应方向的判断以及平衡的移动影响因素等问题,综合性较强,有些难度。
(1)A.当满足ν逆(H2) = 2 ν 正(CO) = ν 正(H2) 时,该反应达到平衡状态,所以当2 ν逆(H2) = ν 正(CO) 时该反应没有达到平衡状态, A项错误;
B.反应前后气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能据此判断平衡状态,B项错误;
C.反应前后气体的总质量不变但气体的总物质的量减小,其平均相对分子质量增大,当混合气体的平均相对分子质量不变时各物质的物质的量不变,反应达到平衡状态,C项正确;
D. CH3OH、CO、H2的浓度都不再发生变化时,正逆反应速率相等,反应达到平衡状态,故D项正确;
E.容器内CO、H2、CH3OH的浓度之比为1:2:1时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始浓度及转化率有关,E项错误;
F.CO、H2、CH3OH的速率之比为1:2:1时该反应可能达到平衡状态也可能没有达到平衡状态,因为没有明确反应方向,所以不能判断平衡状态,F项错误;故选CD;
故答案为:CD。
(2). 相同压强下,升高温度平衡向吸热方向移动,根据图知相同压强下升高温度CO转化率降低,说明平衡逆向移动,则正反应是放热反应,△H<0;
故答案为:<。
(3)①在一定温度下,若将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,依据平衡三段式列式计算;
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始量(mol·L-1)a 2a 0
变化量(mol·L-1) a×50% a 0.5a
平衡量(mol·L-1) 0.5a a 0.5a
则该反应的平衡常数 K= ![]() =
= ![]() ,
,
故答案为:![]() 。
。
②若此时再向该容器中投入a mol CO、2amol H2 和 a mol CH3OH,浓度为 c(CO)= 0.5amol·L-1 + 0.5amol·L-1 = amol·L-1 ,c(H2)= amol·L-1 + amol·L-1 =2amol·L-1
c(CH3OH)= 0.5amol·L-1 + 0.5amol·L-1 = amol·L-1 ,Q = ![]() =
= ![]() < K ,平衡正向移动,
< K ,平衡正向移动,
故答案为:正向移动。
③缩小体积压强增大平衡正向移动,
A.容器体积降为原来的一半,平衡正向移动,氢气的物质的量减少导致氢气浓度减小但大于未减小容器体积时浓度,A项错误;
B.压强增大,反应物、生成物浓度都增大,所以正逆反应速率都增大,B项正确;
C.平衡正向移动,则甲醇的物质的量增加,C项正确;
D.平衡正向移动,氢气的物质的量减少、甲醇的物质的量增大,所以重新平衡时,![]() 减小,D项错误;故选BC,
减小,D项错误;故选BC,
故答案为:BC。