能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH
3OH(l)+3O
2(g)
2CO
2(g)+4H
2O(g) △H= -1275.6 kJ·mol
—1②H
2O(l)
H
2O(g) △H="+" 44.0 kJ.mo
—1写出表示甲醇燃烧热的热化学方程式
。
(2)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H
2(g)

CH
3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H
2和一定量的CO后,CO和CH
3OH(g)的浓度随时间变化图。

①在“图1”中,曲线
(填“a”或“b”)表示使用了催化剂。
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是
。(双选)
| A.容器中压强不变 | B.体系的密度不随时间改变 |
| C.v正(H2)=2v逆(CH3OH) | D.CO与H2的物质的量的比不随时间改变 |
③计算该温度下CO(g)+2H
2(g)

CH
3OH(g)的化学平衡常数K=
。
④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P
1、P
2,且P
1<P
2)。
(3)CaSO
4是一种微溶物质,已知K
sp(CaSO
4)=9.10×10
-6。现将c mol·L
-1 CaCl
2溶液与2.00×10
-2 mol·L
-1 Na
2SO
4溶液等体积混合生成沉淀,则c的最小值是
(结果保留3位有效数字)。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案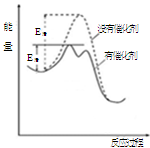
 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
