题目内容
某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、SO42—和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如下: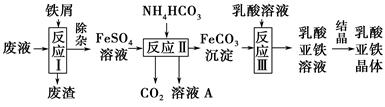
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+??2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=________。
(2)反应Ⅱ需控制反应温度低于35 ℃,其目的是________________,该反应的化学方程式是________________。检验溶液A中是否含Fe2+的实验操作方法是_________________________________________________________。
(3)已知:FeCO3(s)??Fe2+(aq)+CO32—(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因______________________________________________。
(4)结晶过程必须控制在一定的真空度条件下进行,原因是_______________________________________________________。
(1)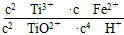
(2)防止NH4HCO3分解(或减少Fe2+的水解)
FeSO4+2NH4HCO3=FeCO3↓+H2O+CO2↑+(NH4)2SO4 取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水或H2O2,溶液呈血红色,证明有Fe2+,反之,不含有Fe2+
(3)CO32—与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
(4)有利于水的蒸发、防止Fe2+被氧化
解析

二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
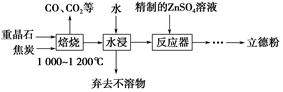
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
| 沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
选择下列实验方法分离物质,将最好的分离方法的序号填在横线上。
| A.萃取分液法 | B.加热法 | C.结晶法 | D.分液法 E.过滤法 F.蒸馏法 |
(2)___________分离二氧化硅与氯化铵的化合物;
(3)___________分离水和煤油的混合物;
(4)____ _______分离碘和酒精;
(5)___________分离溴水中的溴和水。
利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH值如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的PH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
(1)若下列物质均能把Fe2+氧化为Fe3+,则过程①中可选择加入的氧化剂是 。
a.Cl2 b.MnO2 c.浓HNO3 d.H2O2
(2)过程②中,所得滤渣的成分是 。
(3)过程③中,搅拌的目的是 ,发生反应的离子方程式是 。
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是___________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 +
 O2 → MnO2 + CO2。
O2 → MnO2 + CO2。现在空气中加热 460.0 g的MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 。(摩尔质量/g·:MnCO3 115 MnO2 87 MnO 71)
化学实验研究的常用方法,
| A.蒸馏 | B.萃取 | C.过滤 | D.结晶 E.分液 F.纸上层析,请填空(填字母): |
用四氯化碳提取溴水中的溴单质的方法 ;
分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)的方法 ;
从含有少量氯化钠的硝酸钾溶液中提取硝酸钾的方法 。
 BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。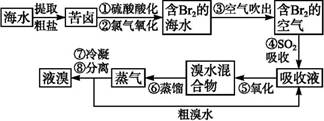
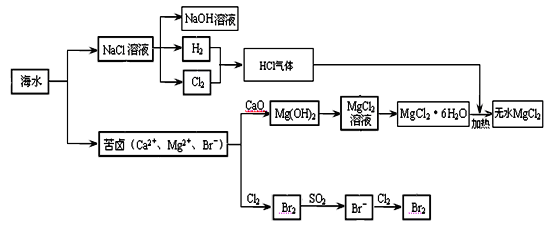
 MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。