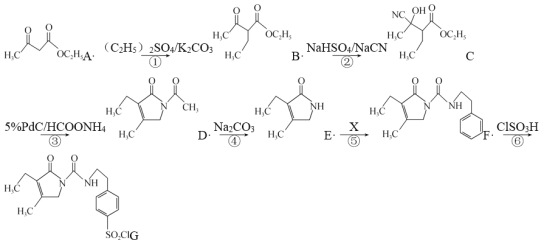
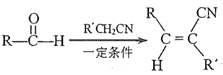
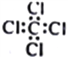题目内容
【题目】NA是阿伏加德罗常数的值。下列说法一定正确的是
A. 在一密闭容器中充入2mol SO2和1mol O2,充分反应后分子总数为2NA
B. 常温常压下,124g P4(正四面体结构)中所含P﹣P键数目为4NA
C. 标准状况下,11.2L氯气和一氧化碳组成的混合气体所含原子数为NA
D. 常温常压下,92g C2H6O中所含乙醇分子数为2NA
【答案】C
【解析】
A、根据二氧化硫与氧气的反应是可逆反应,不可能完全生成三氧化硫分析;
B、求出白磷的物质的量,然后根据1mol白磷中含6molP-P键来分析;
C.标况下,11.2L混合气体的物质的量为0.5mol,0.5mol氯气和CO的混合气体中含有1mol原子;
D、分子式为 C2H6O存在同分异构体。
A、由于二氧化硫与氧气反应生成三氧化硫的反应是可逆反应,2molSO2和1molO2反应生成的三氧化硫的物质的量小于2mol,充分反应后可得到SO3的分子数小于2NA,选项A错误;
B、124g白磷分子(分子式为P4)的物质的量是![]() =1mol,白磷是正四面体型结构,分子中含有6个P-P共价键,所以1mol白磷分子中含有6molP-P键,含有P-P共价键数目为6NA,选项B错误;
=1mol,白磷是正四面体型结构,分子中含有6个P-P共价键,所以1mol白磷分子中含有6molP-P键,含有P-P共价键数目为6NA,选项B错误;
C.标准状况下,11.2L氯气和CO的混合气体的物质的量为0.5mol,均为双原子分子,故含有1mol原子,含有的原子数为NA,选项C正确;
D. 分子式为 C2H6O的物质可以为乙醇或二甲醚,选项D错误。
答案选C。

【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下
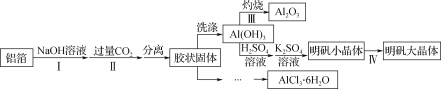
已知:(1) AlCl3·6H2O易溶于水、乙醇及乙醚;
(2) 明矾在水中的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)步骤Ⅱ中生成Al(OH)3的离子方程式为____________________________________________。
(2)步骤Ⅲ灼烧Al(OH)3所用实验室常用仪器为________,为了提高Al2O3纯度,需________(填操作步骤)。
(3)制备AlCl3·6H2O的工业生产中,胶状固体用酸浸取后,还需要通入HCl气体。通入HCl的作用主要有两点:____________和____________。
(4)已知:在不同温度条件下向一定量的氯化铝溶液中通入HCl气体,通入量对AlCl3·6H2O结晶量和结晶效率的影响如图,请补充完整由胶状固体制备AlCl3·6H2O晶体的实验方案:向胶状固体滴加一定浓度盐酸,直至恰好完全溶解,__________________________。