题目内容
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
![]() △H=+180 kJ·mol-1
△H=+180 kJ·mol-1
![]() △H=+68 kJ·mol-1
△H=+68 kJ·mol-1
则![]() △H=__________ kJ·mol-1
△H=__________ kJ·mol-1
(2)对于反应![]() 的反应历程如下:
的反应历程如下:
第一步:
第二步:![]()
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1正·c2(NO),υ逆=k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是______(填标号)
A 整个反应的速率由第一步反应速率决定
B 同一温度下,平衡时第一步反应的k1正/k1逆越大,反应正向程度越大
C 第二步反应速率低,因而转化率也低
D 第二步反应的活化能比第一步反应的活化能高
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:![]() △H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
△H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp=___________kPa-1(K
(4)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下
I: NO+Pt(s)=NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]
Ⅱ:CO+Pt(s)=CO(*)
III:NO(*)=N(*)+O(*)
IV:CO(*)+O(*)=CO2+2Pt(s)
V:N(*)+N(*)=N2+2 Pt(s)
VI:NO(*)+N(*)=N2O+2 Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。

①330℃以下的低温区发生的主要反应的化学方程式是__________________________。
②反应V的活化能_____反应VI的活化能(填“<”、“>”或“=”),理由是_________________。
【答案】-112 BD 0.04 降低温度,由于反应放热,所以平衡向正反应方向移动,容器中气体分子数减少,总压强也减小;若温度降低,体积不变,根据阿伏加德罗定律,总压强减小 CO+2NO![]() CO2+N2O > 生成N2O的选择性高,说明反应VI的化学反应速率大,该反应的活化能就小
CO2+N2O > 生成N2O的选择性高,说明反应VI的化学反应速率大,该反应的活化能就小
【解析】
(1)根据盖斯定律解答即可;(2)根据影响化学反应速率因素和化学平衡的条件进行判断反应的问题;(3)运用三段式和Kp的含义计算;(4)根据反应的机理和图像分析。
(1)已知汽车气缸中氮及其化合物发生如下反应:
① N2(g)+ O2(g)![]() 2NO(g) △H=+180 kJ·mol-1 ② N2(g)+ 2O2(g)
2NO(g) △H=+180 kJ·mol-1 ② N2(g)+ 2O2(g)![]() 2NO2(g) △H=+68 kJ·mol-1,运用盖斯定律将②-①得,2NO(g)+O2(g)=2NO2(g)H=+68 kJ·mol-1-180 kJ·mol-1=-112 kJ·mol-1;答案:-112。
2NO2(g) △H=+68 kJ·mol-1,运用盖斯定律将②-①得,2NO(g)+O2(g)=2NO2(g)H=+68 kJ·mol-1-180 kJ·mol-1=-112 kJ·mol-1;答案:-112。
(2) A项,对于反应2NO(g)+ O2(g) ![]() 2NO2(g)的反应历程如下:第一步:2NO(g)
2NO2(g)的反应历程如下:第一步:2NO(g) ![]() N2O2(g)(快速平衡);第二步:N2O2(g)+ O2(g)
N2O2(g)(快速平衡);第二步:N2O2(g)+ O2(g)![]() 2NO2(g)(慢反应),决定总反应速率的是第二步,故A错误;B项,因为υ正=k1正·c2(NO),υ逆=k1逆·c(N2O2),同一温度下达到平衡时υ正=υ逆,即k1正/k1逆= c(N2O2)/ c2(NO)=反应的平衡常数,k1正/k1逆越大,反应正向程度越大,故B正确;C项,化学反应速率快慢,与转化率没有关系,故C错误;D项,化学反应的活化能越高,活化分子数目越越少,有效碰撞次数越少,化学反应速率越慢,所以第二步比第一步反应的活化能高,故D正确;答案:BD。
2NO2(g)(慢反应),决定总反应速率的是第二步,故A错误;B项,因为υ正=k1正·c2(NO),υ逆=k1逆·c(N2O2),同一温度下达到平衡时υ正=υ逆,即k1正/k1逆= c(N2O2)/ c2(NO)=反应的平衡常数,k1正/k1逆越大,反应正向程度越大,故B正确;C项,化学反应速率快慢,与转化率没有关系,故C错误;D项,化学反应的活化能越高,活化分子数目越越少,有效碰撞次数越少,化学反应速率越慢,所以第二步比第一步反应的活化能高,故D正确;答案:BD。
(3)向10L密闭容器中分別充入0.1 mol NO2和0.2 mol CO,反应10min达到平衡,体系内圧強由75kPa减少到68.75kPa,则反应该中转化N2的浓度为xmol/L
2NO2(g)+ 4CO(g)![]() 4CO2(g) + N2(g)
4CO2(g) + N2(g)
幵始(mo/L) 0.01 0.02 0 O
变化(mo/L) 2x 4x 4x x
平衡(mol/L)0.01-2x 0.02-4x 4x x
根据压强比就等于物质的量之比:75kPa/68.75kPa=(0.01+0.02)/(0.01-2x+0.02-4x+4x+x),解得x=0.0025;Kp=[(68.75![]() 0.01/0.0275)4
0.01/0.0275)4![]() 68.75×0.0025/0.0275]/[(68.75×0.005/0.0275)2×(68.75×0.01/0.0275)4]=0.04;因为该反应为放热反应,所以降低温度平衡正向移动,气体的总物质的量减小,压强减小;若温度降低,体积不变,根据阿伏加德罗定律,总压强减小。答案:0.04;降低温度,由于反应放热,所以平衡向正反应方向移动,容器中气体分子数减少,总压强也减小;若温度降低,体积不变,根据阿伏加德罗定律,总压强减小。
68.75×0.0025/0.0275]/[(68.75×0.005/0.0275)2×(68.75×0.01/0.0275)4]=0.04;因为该反应为放热反应,所以降低温度平衡正向移动,气体的总物质的量减小,压强减小;若温度降低,体积不变,根据阿伏加德罗定律,总压强减小。答案:0.04;降低温度,由于反应放热,所以平衡向正反应方向移动,容器中气体分子数减少,总压强也减小;若温度降低,体积不变,根据阿伏加德罗定律,总压强减小。
(4)①由图可知330℃以下的低温区中CO2、N2O含量较高,故发生的主要反应的化学方程式是CO+2NO![]() CO2+N2O;答案:CO+2NO
CO2+N2O;答案:CO+2NO![]() CO2+N2O。
CO2+N2O。
②低温区N2O选择性高于N2 ,由此可推断出: V反应的活化能 > VI反应的活化能,理由是反应的活化能小,化学反应速率大,选择性高;答案:> ;生成N2O的选择性高,说明反应VI的化学反应速率大,该反应的活化能就小。

【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H3=________kJ/mol(用含a、b的代数式表示)。
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8 mol CO2(g)、16 mol H2(g) |
乙 | w mol CO2(g)、x mol H2(g)、y mol CO(g)、z mol H2O(g) |
甲容器15 min后达到平衡,此时CO2的转化率为75%。则0~15 min内平均反应速率v(H2)=______,此条件下该反应的平衡常数K=______。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是:y______z(填“>”、“<”或“=”),且y=______(用含x、w的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:
C6H5CH=H2(g)+CO(g) +H2O(g) △H ”中乙苯的平衡转化率影响如图所示:

则△H_____0(填“>”、“<”或“=”),压强p1、p2、p3从大到小的顺序是________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
CO2+NO。当温度高于225℃时,反应速率v 正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为________。
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.反应粗产物倒入f中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯.
回答下列问题:
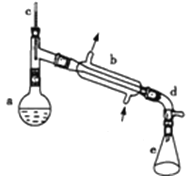
(1)由环己醇制取环己烯的反应类型为_________;
(2)装置b的冷凝水方向是______(填下进上出或上进下出);
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称为____.
(5)在分离提纯中,使用到的仪器f名称是_____,分离氯化钙的操作是_____.
(6)合成过程中加入浓硫酸的作用是_____.