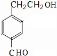
题目内容
已知硫酸溶液的质量分数越大时,其溶液的密度越大,将80%和20%的两种H2SO4溶液等体积混合后,溶液的质量分数为( )
| A、大于50% | B、等于50% | C、小于50% | D、无法确定 |
分析:令质量分数分别为20%与80%的硫酸溶液的密度分别为xg/ml、yg/ml,硫酸溶液的密度随浓度增大而增大,所以x<y.假定体积为1ml,混合后溶质质量为混合前两溶液中溶质质量之和,混合后溶液质量为混合前溶液质量之和,根据质量分数定义用x、y表示出混合后的质量分数,结合密度关系判断.
解答:解:设质量分数分别为20%与80%的硫酸溶液的密度分别为xg/ml、yg/ml;硫酸溶液的密度随浓度增大而增大,所以x<y.
假定体积为1ml,则20%硫酸溶液的质量为1ml×xg/ml=xg,溶质硫酸的质量为xg×20%;
80%的硫酸溶液的质量为1ml×yg/ml=yg,溶质硫酸的质量为yg×80%;
所以混合后硫酸的溶质质量分数=
=
=
=80%-60%
,由于x<y,所以
>1,
所以80%-60%
>50%,
故选:A.
假定体积为1ml,则20%硫酸溶液的质量为1ml×xg/ml=xg,溶质硫酸的质量为xg×20%;
80%的硫酸溶液的质量为1ml×yg/ml=yg,溶质硫酸的质量为yg×80%;
所以混合后硫酸的溶质质量分数=
| xg×20%+yg×80% |
| xg+yg |
20%+80%
| ||
1+
|
20%-80%+80%(1+
| ||
1+
|
| 1 | ||
1+
|
| y |
| x |
所以80%-60%
| 1 | ||
1+
|
故选:A.
点评:本题考查溶液浓度的计算和大小比较,题目难度较大,注意硫酸的浓度越大,密度越大,并且解题规律是十分重要的.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
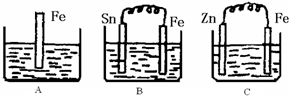
 2Z
2Z
 ,且E中R′的两个取代基呈对位,已知R、R′为烃基.
,且E中R′的两个取代基呈对位,已知R、R′为烃基.
 ,且属于酯的同分异构体有
,且属于酯的同分异构体有 (任写一种)
(任写一种)
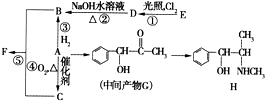 有机物A是重要的化工合成原料,在医药、染料和香料等行业有着广泛的应用.由A制得某药物H的转化关系如图所示(A→G、G→H的反应条件和部分反应物已略去).
有机物A是重要的化工合成原料,在医药、染料和香料等行业有着广泛的应用.由A制得某药物H的转化关系如图所示(A→G、G→H的反应条件和部分反应物已略去).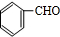
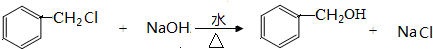
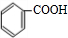 +
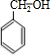
+
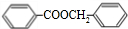 +H2O
+H2O