题目内容
【题目】(1).将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) ![]() H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0
①该反应平衡常数的表达式为K=__________。
②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为________,HI的分解率为_________。
(2)在一定条件下,A气体与B气体反应生成C气体,反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
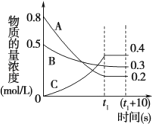
①该反应的化学方程式为:______________
②t1 s时反应物A的转化率为:__________
③0~t1 s内A的反应速率为v(A)=______。
【答案】![]() 0.5mol/L 20% 3A+B
0.5mol/L 20% 3A+B![]() 2C 75%
2C 75% ![]() mol/(L
mol/(L![]() s)
s)
【解析】
(1)①化学平衡常数=![]() ,据此进行解答;②据化学方程式可知,生成0.5mol碘单质分解了1molHI,反应开始前HI浓度为5mol/L,分解率=
,据此进行解答;②据化学方程式可知,生成0.5mol碘单质分解了1molHI,反应开始前HI浓度为5mol/L,分解率=![]() ×100%;
×100%;
(2)①由图象可知,在反应中,A、B的浓度逐渐减小,C的浓度逐渐增大,则A、B为反应物,C为生成物,t1s时A、B浓度不变且不为0,说明是可逆反应,化学反应中浓度变化之比等于化学计量数之比,进而书写反应方程式;
②t1s时反应物A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,A的转化率=![]() ×100%;
×100%;
③0~t1s内A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,根据v=![]() 计算v(A)。
计算v(A)。
(1) ①反应2HI(g)H2(g)+I2(g)的平衡常数表达式为:K=![]() =
= ![]() ,故答案为:
,故答案为:![]() ; ②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,根据反应2HI(g)H2(g)+I2(g)可知,平衡时c(H2)=c(I2)=0.5mol/L,反应消耗HI的浓度为:c(HI)消耗=2c(H2)═1mol/L,则反应前HI的总浓度为:4mol/L+1mol/L=5mol/L,所以HI的分解率=
; ②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,根据反应2HI(g)H2(g)+I2(g)可知,平衡时c(H2)=c(I2)=0.5mol/L,反应消耗HI的浓度为:c(HI)消耗=2c(H2)═1mol/L,则反应前HI的总浓度为:4mol/L+1mol/L=5mol/L,所以HI的分解率=![]() ×100%=
×100%=![]() ×100%=20%,故答案为:0.5mol/L;20%;
×100%=20%,故答案为:0.5mol/L;20%;
(2)①由图象可知,在反应中,A、B的浓度逐渐减小,C的浓度逐渐增大,则A、B为反应物,C为生成物,t1s时A、B浓度不变且不为0,说明是可逆反应,t1s内△c(A):△c(B):△c(C)=(0.8-0.2):(0.5-0.3):0.4=3:1:2,化学反应中浓度变化之比等于化学计量数之比,则化学方程式为3A+B![]() 2C,故答案为:3A+B
2C,故答案为:3A+B![]() 2C;
2C;
②t1s时反应物A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,A的转化率=![]() ×100%=
×100%=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
③0~t1s内A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,则v(A)=![]() =
=![]() mol/(L
mol/(L![]() s),故答案为:
s),故答案为:![]() mol/(L
mol/(L![]() s)。
s)。

 名校课堂系列答案
名校课堂系列答案