题目内容
15.为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.请回答下列问题: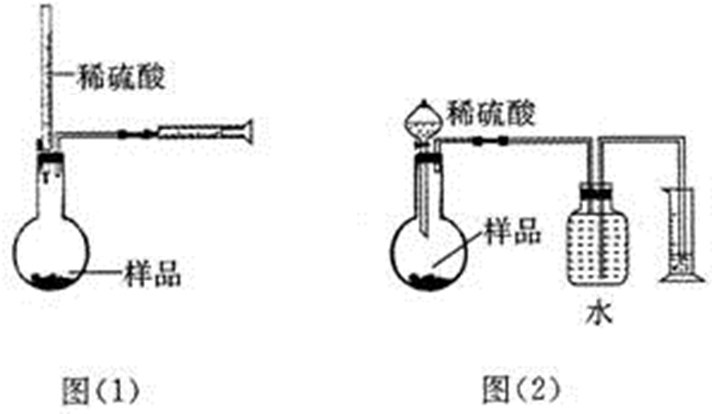
(1)甲同学用图(1)装置来测定,在没有放样品前,检查该装置气密性的方法之一是从酸式滴定管向烧瓶中加入一定量的水,观察到注射器增大的体积与加入水的体积相等现象,证明此装量不漏气.实验时称得样品的质量为mg,酸式滴定管的起始读数为amL,终了读数为bmL,注射器测定排出的气体为c mL(已折算成标准状况),该样品中Na2C03的质量分数为(用含a、b、c、m的代数式表示)$\frac{53(c-b+a)}{11200m}$.
(2)本实验选用稀H2S04而未选用稀盐酸的原因是稀硫酸不易挥发,稀盐酸易挥发出氯化氢气体,产生误差.
(3)乙同学观察了甲同学的实验后很受启发,并发现自己的图(2)原实验设计方案会造成误差.其原因之一可能是C02在水中溶解度较大,引起测量气体体积减小.丙同学经思考后.建议乙同学将图(2)中某部分稍作改进,就可避免此种误差,写出你的改进方案将水换成饱和NaHCO3溶液,或在贮水瓶中的水面上加一层植物油都可防止CO2溶于水.
(4)丁同学提出将图(2)装置中量气装置去掉,只用反应装置和天平也能较准确地测出样品中Na2C03的质量分数,请你分析丁同学方案中,除了测定样品的质量,还需测定的另两个数据是反应前装有药品的整个装置的质量、反应后整个装置的质量.
(5)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种与上述各方法不同的实验方法称量一定质量的样品配成溶液,加入足量的BaCl2溶液后得到沉淀,将沉淀进行过滤、洗涤、干燥、冷却、称量.由沉淀(BaCO3)质量计算出Na2CO3的质量,最后计算出Na2CO3的质量分数.
分析 (1)根据在密封条件容器中气体体积不变判断;碳酸钠与硫酸反应产生的二氧化碳的体积为(c-b+a)mL,根据二氧化碳的体积可计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数;
(2)稀硫酸不易挥发,稀盐酸易挥发出,挥发出来的氯化氢对实验有影响;
(3)根据减少二氧化碳的溶解判断,例如可以用饱和碳酸氢钠溶液,或水面上加一层植物油等;
(4)根据反应前后整个装置的质量差可知产生的二氧化碳的质量,根据二氧化碳的质量再计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数;
(5)测定NaOH、Na2C03混合物中Na2C03的质量分数,可以用氯化钡或氯化钙将碳酸根离子沉淀,根据沉淀的质量可计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数.
解答 解:(1)根据在密封条件容器中气体体积不变判断可知,当注射器增大的体积与加入水的体积相等时,则可以说明此装量不漏气,碳酸钠与硫酸反应产生的二氧化碳的体积为(c-b+a)mL,则二氧化碳的物质的量为$\frac{(c-b+a)×1{0}^{-3}}{22.4}$mol,根据碳元素守恒可知,样品中Na2C03的质量为$\frac{(c-b+a)×1{0}^{-3}}{22.4}$mol×106g/mol=$\frac{106(c-b+a)×1{0}^{-3}}{22.4}$g,所以Na2C03的质量分数为$\frac{\frac{106(c-b+a)×1{0}^{-3}}{22.4}}{m}$=$\frac{53(c-b+a)}{11200m}$,
故答案为:注射器增大的体积与加入水的体积相等;$\frac{53(c-b+a)}{11200m}$;
(2)稀硫酸不易挥发,稀盐酸易挥发出,挥发出来的氯化氢对实验有影响,所以不能用稀盐酸而要用稀硫酸,
故答案为:稀硫酸不易挥发,稀盐酸易挥发出氯化氢气体,产生误差;
(3)减少二氧化碳的溶解就在就可减小误差,所以可以用饱和碳酸氢钠溶液,或水面上加一层植物油等,
故答案为:将水换成饱和NaHCO3溶液,或在贮水瓶中的水面上加一层植物油都可防止CO2溶于水;
(4)根据反应前后整个装置的质量差可知产生的二氧化碳的质量,根据二氧化碳的质量再计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数,所以除了测定样品的质量,还需测定的另两个数据是反应前装有药品的整个装置的质量,反应后整个装置的质量,
故答案为:反应前装有药品的整个装置的质量;反应后整个装置的质量;
(5)测定NaOH、Na2C03混合物中Na2C03的质量分数,可以用氯化钡或氯化钙将碳酸根离子沉淀,根据沉淀的质量可计算出碳酸钠的质量,进而确定样品中Na2C03的质量分数,所以实验方法为称量一定质量的样品配成溶液,加入足量的BaCl2溶液后得到沉淀,将沉淀进行过滤、洗涤、干燥、冷却、称量.由沉淀(BaCO3)质量计算出Na2CO3的质量,最后计算出Na2CO3的质量分数,
故答案为:称量一定质量的样品配成溶液,加入足量的BaCl2溶液后得到沉淀,将沉淀进行过滤、洗涤、干燥、冷却、称量.由沉淀(BaCO3)质量计算出Na2CO3的质量,最后计算出Na2CO3的质量分数.
点评 本题以NaOH、Na2C03混合物中Na2C03的质量分数的测定载体,考查了实验方案的设计、质量分数的计算等知识,内容较多,难度中等.

 阅读快车系列答案
阅读快车系列答案
回答下列问题:
(1)检查装置气密性的方法是在仪器D的出气口连接导管,将导管的末端插入水槽中的水中,用酒精灯轻轻加热圆底烧瓶,若导管口有气泡冒出且停止加热后,在导管中形成一段水柱,说明装置气密性良好,a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
| A. | 实验室中用生石灰与浓氨水混合的方法不能制得氨气 | |
| B. | 中和滴定实验中,所用滴定管和锥形瓶均不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的1/3 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
| A. | 将温度迅速升高20℃,两溶液的pH均增大 | |
| B. | 加水稀释相同倍数后,两溶液的pH同等程度减小 | |
| C. | 加少量的醋酸钠固体后,两溶液的pH均增大 | |
| D. | 加足量的锌充分反应后,两溶液产生的氢气的量一样多 |
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
| A. | I-是该反应的催化剂 | B. | IO-也是该反应的催化剂 | ||
| C. | 反应活化能等于98 kJ•mol-1 | D. | v(H2O2)=v(H2O)=v(O2) |
其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选不得分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)某温度下SO2的转化反应的2SO2(g)+O2(g)?2SO3(g)平衡常数K=532.4.
下面三个混合体系中各物质的浓度如下表:
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
体系(1)逆向体系(2)正向体系(3)已平衡(填正向、逆向或已平衡).
 1,2,3,4-四氢化萘的结构简式是
1,2,3,4-四氢化萘的结构简式是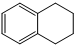 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: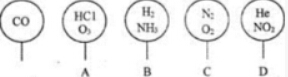 取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( )
取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( ) (Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算:
(Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算: