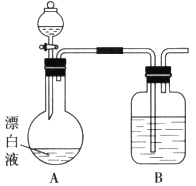
��Ŀ����
����Ŀ������β��(��CO��SO2��NO��)�dz��п�����ȾԴ֮һ�������ķ���֮һ������������������װһ������ת������������ʹһ����̼��һ��������Ӧ���ɿɲ��������̬ѭ���������壬���ٽ����������ת����
(1)����β���е��������γɵ���Ҫ������____ ____��
(2)д���ڴ�����������CO��NO��Ӧ�Ļ�ѧ����ʽ��_______ ________��
(3)ʹ������ת��������ȱ������һ���̶���������ŷŷ�������ȣ��п��ܴٽ���������γɣ���ԭ���� ��
(4)���и����ʩ�У������ڻ�����п�����Ⱦ����________(�����)��
A���������̫���ܣ�������Դ����
B��ʹ�õ綯������������������
C��ֲ���ֲݣ��̻�����
���𰸡�(1)SO2��NO��2�֣�(2)2CO��2NO![]() N2��2CO2��3�֣�
N2��2CO2��3�֣�
(3)���ڴٽ���SO2��ת�������ɵ�SO3���࣬SO3��H2O===H2SO4����˿�����ȣ�3�֣�
(4)ABC��2�֣�
��������
���������(1����������������ж�������͵������������β���к�CO��SO2��NO�ȣ����Ե��������γɵ���Ҫ������SO2��NO��
��2�����������Ϣ��CO��NO��Ӧ�����ɿɲ��������̬����ѭ���������壮��������CO2��N2����Ӧ�ķ���ʽΪ2CO��2NO![]() N2��2CO2��
N2��2CO2��
��3����������ת�������ٽ���SO2��ת�������ɵ�SO3���࣬SO3+H2O=H2SO4������˿�������ȣ�
��4��������п�����Ⱦ��ֲ�������ܿ���CO2�������ӣ�������������β�������࣬CO��SO2��NO������û��ֱ�ӵ�Ч������ѡABC��

 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�����Ŀ����15�֣�I��������Ԫ��X��Y��Z��Ԫ�����ڱ��е�λ������ͼ��ʾ������YԪ��ԭ�ӵ������������ǵ��Ӳ������������ش��������⣺
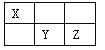
��1��YԪ����Ԫ�����ڱ��е�λ���� ��
��2���о�һ����ʵ֤��YԪ����ZԪ�صķǽ�����ǿ���� ��
��3��X����̬�⻯����������������Ӧ��ˮ���ﷴӦ�����Ρ�������Һ��pH 7��������������������������������ԭ��Ϊ�������ӷ���ʽ��ʾ�� ��
��4��XԪ�ص�ij��Һ̬�⻯������к���18�����ӣ�ֻ���ڹ��۵������������ڼ�����Һ���ܹ���CuO��ԭΪCu2O��ͬʱ����һ�ֲ������ѭ�������塣�÷�Ӧ�Ļ�ѧ����ʽΪ ��
II����֪���淴Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g)��ƽ�ⳣ�����±���
CO2(g)+H2(g)��ƽ�ⳣ�����±���
�¶�/�� | 500 | 700 | 850 | 1 000 |
ƽ�ⳣ�� | 2.5 | 1.7 | 1.0 | 0.6 |
��5���÷�Ӧ��H 0����������������������
��6��850 ��ʱ������һ�ݻ��̶����ܱ�������ͬʱ����1.0 mol CO��3.0 mol H2O��1.0 molCO2��x mol H2����Ҫʹ������Ӧ��ʼʱ������У���xӦ����������� ��
��x��5.0������Ӧ�ﵽƽ��ʱ��n(H2)�� ��