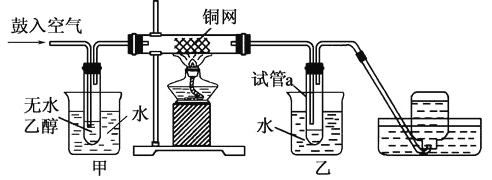
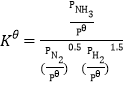
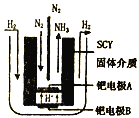
题目内容
【题目】已知X、Y、Z都是元素周期表中前四周期的元素,他们的原子序数依次增大,并且不在同一个周期。元素X的原子核外有8个运动状态不同的电子。元素Y基态原子的最外电子层没有空轨道,而且成对电子数是未成对电子数的2倍。元素Z基态原子的内层轨道全部排满电子,且最外层电子数为2。

(1)基态X原子的核外电子排布图(轨道表达式)为_________,X的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是________________________。
(2)X与Y形成的固体YX3中存在(a)所示的三聚分子,该分子中Y原子的杂化轨道类型为_______。基态Y原子中,核外能级最高的原子轨道上,具有的电子数为______。
(3)X与Y还可以形成YX42-离子,YX42-的空间构型为_________,写出一种与YX42-互为等电子体的分子的化学式________。
(4)Z与Y的离子形成化合物晶体的晶胞如图(b)所示。在晶胞中,Z离子的配位数为_________,该化合物的化学式为______。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4]Cl2,1mol该配合物中含有![]() 键的数目为_______。
键的数目为_______。
【答案】 水分子与乙醇分子之间形成氢键 sp3 4 正四面体 CCl4或SiCl4等 4 ZnS 16NA
水分子与乙醇分子之间形成氢键 sp3 4 正四面体 CCl4或SiCl4等 4 ZnS 16NA
【解析】
元素X的原子核外有8个运动状态不同的电子,则X是8号O元素;元素Y基态原子的最外电子层没有空轨道,而且成对电子数是未成对电子数的2倍,则Y是S元素;元素Z基态原子的内层轨道全部排满电子,且最外层电子数为2,Z是Zn元素。据此分析解答。
根据上述分析可知X是O元素,Y是S元素,Z是Zn元素。
(1)根据原子构造原理,结合泡利不相容原理和可知基态O原子的核外电子排布图为 ;由于O原子半径小,元素的非金属性强,H2O中的共价键的共用电子对偏向O原子一方,使H几乎成为裸露的质子,因此导致水分子与乙醇分子之间形成氢键,增加了分子之间的吸引力,因此水容易溶于乙醇,而H2S分子与乙醇分子之间没有氢键的存在,在乙醇在溶解度很小;
;由于O原子半径小,元素的非金属性强,H2O中的共价键的共用电子对偏向O原子一方,使H几乎成为裸露的质子,因此导致水分子与乙醇分子之间形成氢键,增加了分子之间的吸引力,因此水容易溶于乙醇,而H2S分子与乙醇分子之间没有氢键的存在,在乙醇在溶解度很小;
(2)S原子与O原子形成三聚分子,每个S原子与4个O原子形成共价键,且不含孤电子对,根据价层电子对互斥理论可知SO3中S原子杂化轨道类型为sp3杂化;基态Y原子的核外电子排布式是1s22s22p63s23p4,可见其能级最高的原子轨道是3p轨道,该轨道上具有的电子数为4个;
(3)X与Y还可以形成SO42-离子,在SO42-离子中S原子的价层电子对数为:4+![]() =4,且不含孤电子对,根据价层电子对互斥理论可知SO42-离子的空间构型为正四面体,根据等电子体的含义可知与SO42-互为等电子体的分子的化学式可能为CCl4或SiCl4等;
=4,且不含孤电子对,根据价层电子对互斥理论可知SO42-离子的空间构型为正四面体,根据等电子体的含义可知与SO42-互为等电子体的分子的化学式可能为CCl4或SiCl4等;
(4)根据S与Zn的离子形成化合物晶体的晶胞结构可知:在晶胞中,Z离子的配位数为4,在一个晶胞中含有Zn:![]() ,含有S原子数为4,Zn:S=1:1,所以该化合物的化学式为ZnS;
,含有S原子数为4,Zn:S=1:1,所以该化合物的化学式为ZnS;
(5)Zn的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2中,在一个配位体中含有3个σ键,四个配位体共含有4×3=12个,还有NH3中的N原子与Zn2+形成的四个配位键也属于σ键,因此1个[Zn(NH3)4]Cl2中含有的σ键为12+4=16个,则1mol该配合物中含有σ键的数目为16NA。

【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。
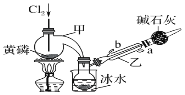
(1)仪器乙的名称是________;其中,与自来水进水管连接的接口编号是________。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________。实验过程中,为减少PCl5的生成,应控制____________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________。若滴定终点时俯视读数,则PCl3的质量分数________(填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)