题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用相应的化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素的原子结构示意图是_____________________________。
(2)④、⑥、⑧的原子半径由小到大的顺序为___________(用元素符号作答)。
(3)②、③、⑨的最高价氧化物的水化物的酸性由弱到强的顺序是______________(用化学式作答)。
(4)由表中两种元素的原子按1:1组成的共价化合物M,M为常见液态化合物,其稀溶液易被催化分解,请写出M的电子式_____________,M的结构式_____________。
(5)写出⑦元素的最高价氧化物对应水化物分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液反应的离子方程式_____________、_____________。
(6)⑥的金属性强于⑦,下列表述中能证明这一事实的是_____________。
a.⑥的单质和⑦的单质熔沸点不同
b.⑥的最高价氧化物水化物的碱性比⑦的最高价氧化物水化物的碱性强
c.⑦最外层的电子数比⑥多
d.⑦的单质与稀盐酸反应比⑥的缓和一些
(7)①和④形成的气态氢化物与①和⑧形成的气态氢化物相比较,_____________沸点高(填化学式),理由是_______________________________________。
【答案】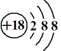 O<S<Na H2CO3<HNO3<HClO4
O<S<Na H2CO3<HNO3<HClO4 ![]() H-O-O-H Al(OH)3+OH- =AlO2-+2H2O Al(OH)3+3H+==Al3++3H2O bd H2O H2O分子间能形成氢键,氢键可以极大地提高水的熔沸点
H-O-O-H Al(OH)3+OH- =AlO2-+2H2O Al(OH)3+3H+==Al3++3H2O bd H2O H2O分子间能形成氢键,氢键可以极大地提高水的熔沸点
【解析】
由表中元素所在的位置,可以确定①为氢(H),②为碳(C),③为氮(N),④为氧(O),⑤为氟(F),⑥为钠(Na),⑦为铝(Al),⑧为硫(S),⑨为氯(Cl),⑩为氩(Ar)。
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素是稀有气体氩,其原子结构示意图是 。答案为:
。答案为: ;
;
(2)④、⑥、⑧分别为O、Na、S元素,O的电子层数比Na、S少一层,Na与S同周期且S在Na的右方,由此得出原子半径由小到大的顺序为O<S<Na。答案为:O<S<Na;
(3)②、③、⑨分别为C、N、Cl,碳酸为弱酸,硝酸为强酸,高氯酸为最强的含氧酸,它们的最高价氧化物的水化物的酸性由弱到强的顺序是H2CO3<HNO3<HClO4。答案为:H2CO3<HNO3<HClO4;
(4)由表中两种元素的原子按1:1组成的共价化合物M应为H2O2,M的电子式为![]() ,M的结构式为H-O-O-H。答案为
,M的结构式为H-O-O-H。答案为![]() :H-O-O-H;
:H-O-O-H;
(5)⑦元素的最高价氧化物对应水化物为Al(OH)3,分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液NaOH、H2SO4反应的离子方程式为Al(OH)3+OH- =AlO2- +2H2O、Al(OH)3+3H+==Al3++3H2O。答案为:Al(OH)3+OH- =AlO2- +2H2O;Al(OH)3+3H+==Al3++3H2O;
(6)a.钠的单质和铝的单质熔沸点不同,只能表明离子带电荷、离子半径的差异,与金属性无关,a不合题意;
b.钠的最高价氧化物水化物的碱性比铝的最高价氧化物水化物的碱性强,则表明金属性钠大于铝,b符合题意;
c.铝的最外层的电子数比钠多,与金属性的强弱没有必然联系,c不合题意;
d.铝的单质与稀盐酸反应比钠的缓和一些,表明金属失电子能力铝小于钠,d符合题意;
故选bd。答案为:bd;
(7)H2O与H2S相比,H2O因分子间形成氢键,增大了分子间作用力,导致沸点升高,所以H2O的沸点高,理由是H2O分子间能形成氢键,氢键可以极大地提高水的熔沸点。答案为:H2O;H2O分子间能形成氢键,氢键可以极大地提高水的熔沸点。

【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
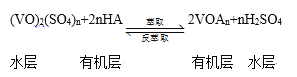
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。



