题目内容
9.常温下,下列各组数据中比值为2:1的是( )| A. | Na2CO3溶液中c (Na+)与c (CO32-)之比 | |
| B. | 0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的盐酸中c (H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c (NH4+)与c (SO42-)之比 | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
分析 A、碳酸钠溶液中,碳酸根离子水解,但是钠离子不会发生水解;
B、0.1mol•L-1的盐酸和0.2 mol•L-1的CH3COOH溶液中醋酸不完全电离;
C、(NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃时,pH=7是显中性的溶液,据此回答判断即可;
D、c(OH-)=$\frac{Kw}{c({H}^{+})}$结合化学式中氢氧根离子和化学式的关系分析.
解答 解:A、碳酸钠溶液中,碳酸根离子水解,但是钠离子不会发生水解,c (Na+)与c (CO32-)之比大于2:1,故A错误;
B、CH3COOH溶液中醋酸不完全电离,0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的盐酸中c (H+)之比小于2:1,故B错误;
C、(NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃时,pH=7是显中性的溶液,故c(H+)=c(OH-),所以
c(NH4+)=2c(SO42-),c (NH4+)与c (SO42-)之比等于2:1,故C正确;
D、根据c(OH-)=$\frac{Kw}{c({H}^{+})}$知,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中氢氧根离子浓度相等为0.01mol/L,但溶质的物质的量浓度之比=0.005mol/L:0.01mol/L=1:2,故D错误;
故选C.
点评 本题考查弱电解质的电离、盐的水解原理的应用等方面的知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
20.向氯化亚铁溶液中滴入氢氧化钠溶液后,沉淀颜色变化顺序为( )
| A. | 红褐色、灰绿色、白色 | B. | 白色、红褐色、黑色 | ||
| C. | 白色、灰绿色、红褐色 | D. | 蓝色、灰绿色、绿色 |
4.下列各组中互为同位素的是( )
| A. | O2和O3 | B. | H2和D2 | C. | CH4和C3H8 | D. | 2He和3He |
19.对于相同物质的量的SO2和SO3,下列说法正确的是( )
| A. | 分子数之比为1:1 | B. | 原子总数之比为1:1 | ||
| C. | SO2和SO3的质量比为1:1 | D. | 氧元素的质量比为1:1 |
16.将10mL NO和NO2的混合气体通入装满水倒立在水槽中的量筒内,一段时间后,最后剩余4mL气体,原混合气体中含NO体积为( )
| A. | 1 mL | B. | 3 mL | C. | 5 mL | D. | 7 mL |
17.下列过程不属于缓慢氧化的是( )
| A. | 呼吸作用 | B. | 钢铁生锈 | C. | 雷电引起火灾 | D. | 食物腐烂 |
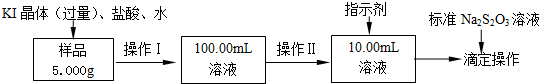
 吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下: