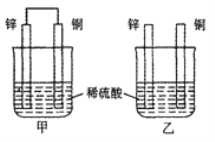
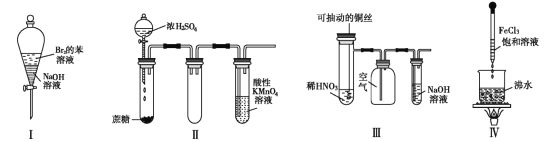
��Ŀ����
����Ŀ�������Ԫ�����ڱ���һ���֣�����Ԫ���ڱ��е�λ�ã����û�ѧ����ش���������:

(1)��ЩԪ���У���ѧ���������ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ______����̬�⻯���У����ȶ�����______������������Ӧˮ�����У�������ǿ����_______��
(2)�ٺ͢�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĵ���ʽΪ______��
(3)�ڡ��۵ĵ����и�������ٵĵ��ʷ�Ӧ����________(�û�ѧʽ��ʾ)��
(4)�ܡ��ߡ��ࡢ��ļ����Ӱ뾶�ɴ�С��˳��Ϊ_____(�����ӷ��ź͡�>����ʾ)��
(5)�͢������������Ӧˮ����֮�䷢����Ӧ�����ӷ���ʽ____________��
(6)�ݢ�����Ԫ�صĵ��ʷе��ɸߵ��͵�˳����_____(�û�ѧʽ�͡�>����ʾ)��
���𰸡� 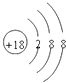 HF HClO4
HF HClO4 ![]() N2 r��Cl������r��O2������r��Mg2+���� r��Al3+�� Al��OH��3+OH��=AlO2��+2H2O {����Al(OH)3+OH��=[Al(OH)4]��} Br2 �� Cl2 �� F2
N2 r��Cl������r��O2������r��Mg2+���� r��Al3+�� Al��OH��3+OH��=AlO2��+2H2O {����Al(OH)3+OH��=[Al(OH)4]��} Br2 �� Cl2 �� F2
�����������ݸ�Ԫ�������ڱ��е�λ�ã��١��ڡ��ۡ��ܡ��ݡ��ޡ��ߡ��ࡢ�ᡢ�⡢���δ���H��C��N��O��F��Na��Mg��Al��Cl��Ar��BrԪ��������Ԫ�������ɺ���ػ�ѧ��������
���ݸ�Ԫ�������ڱ��е�λ�ã��١��ڡ��ۡ��ܡ��ݡ��ޡ��ߡ��ࡢ�ᡢ�⡢���δ���H��C��N��O��F��Na��Mg��Al��Cl��Ar��BrԪ����
��1����ЩԪ���У���ѧ��������õ�ԭ����Ar��Ar�ĺ˵����Ϊ18��Ar��ԭ�ӽṹʾ��ͼΪ![]() ��ͬ���ڴ�����Ԫ�صķǽ���������ǿ����̬�⻯����ȶ�������ǿ������������Ӧˮ������������ǿ��ͬ������ϵ���Ԫ�صķǽ�������������̬�⻯����ȶ�������������������Ӧˮ���������������ǽ�������ǿ��Ԫ�ش���Ԫ�����ڱ������Ͻǣ���̬�⻯�������ȶ�����HF������Fû�����ۣ�����������Ӧˮ������������ǿ����HClO4��
��ͬ���ڴ�����Ԫ�صķǽ���������ǿ����̬�⻯����ȶ�������ǿ������������Ӧˮ������������ǿ��ͬ������ϵ���Ԫ�صķǽ�������������̬�⻯����ȶ�������������������Ӧˮ���������������ǽ�������ǿ��Ԫ�ش���Ԫ�����ڱ������Ͻǣ���̬�⻯�������ȶ�����HF������Fû�����ۣ�����������Ӧˮ������������ǿ����HClO4��
��2���١����ֱ����H��OԪ�أ�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ΪH2O2��H2O2�ĵ���ʽΪ![]() ��
��
��3���١��ڡ����ֱ����H��C��NԪ�أ��ǽ�����C![]() N���ڡ����ĵ����и�����H2��Ӧ����N2��
N���ڡ����ĵ����и�����H2��Ӧ����N2��
��4���ܡ��ߡ��ࡢ���ֱ����O��Mg��Al��ClԪ�������ǵļ���������ΪO2-��Mg2+��Al3+��Cl-�����ݡ���ྶ�����С�����ܡ��ߡ��ࡢ���ļ����Ӱ뾶�ɴ�С��˳��Ϊr��Cl-��![]() r��O2-��
r��O2-��![]() r��Mg2+��
r��Mg2+��![]() r��Al3+����
r��Al3+����
��5���ޡ����ֱ����Na��AlԪ�أ�Na��Al������������Ӧˮ����ֱ�ΪNaOH��Al��OH��3��NaOH��Al��OH��3��Ӧ�Ļ�ѧ����ʽΪNaOH+Al��OH��3=NaAlO2+2H2O{��NaOH+Al��OH��3=Na[Al��OH��4]}�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O{��Al��OH��3+OH-=[Al��OH��4]-}��
��6���ݡ��ᡢ�ֱ����F��Cl��Br�����ǵĵ�������ΪF2��Cl2��Br2��F2��Cl2��Br2����Է���������������F2��Cl2��Br2�ķ��Ӽ�������������ǿ���е��ɸߵ��͵�˳��ΪBr2![]() Cl2
Cl2![]() F2��
F2��

 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��NO2- �ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
��1����֪����NO2 + CO ![]() CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g) ![]() 2NO(g) ��H��+179.5 kJ/mol K2
2NO(g) ��H��+179.5 kJ/mol K2
��2NO(g) +O2(g)![]() 2NO2(g) ��H��-112.3 kJ/mol K3
2NO2(g) ��H��-112.3 kJ/mol K3
��д��NO��CO��Ӧ��������Ⱦ��������Ȼ�ѧ����ʽ____________________________�Լ����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=____________����K1��K2��K3��ʾ��
��2����Ⱦ������NO2��CO��һ�������µķ�ӦΪ��2NO2+4CO![]() 4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����
4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����![]() ����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
�����¶��£�ijʱ�̲��NO2��CO��CO2��N2��Ũ�ȷֱ�Ϊamol/L��0.4mol/L��0.1mol/L��1mol/L��Ҫʹ��Ӧ���淴Ӧ������У�a��ȡֵ��Χ________________��
��3���绯ѧ����NO2-��ԭ������ͼ��
����Դ�ĸ�����____________����A��B��������ӦʽΪ________________��
������������ת����6mol���ӣ���Ĥ������Һ�������仯��![]() Ϊ_____g��
Ϊ_____g��