题目内容
【题目】常温下,甲、乙两烧杯盛有同浓度同体积的稀硫酸将纯锌片和纯铜片分别按图示方式插入其中,以下有关实验现象或结论的叙述正确的是
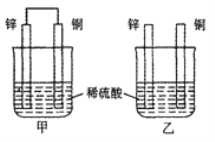
A. 两烧杯中铜片表面均有气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 甲杯溶液的c(H+)减小,乙杯溶液的c(H+)变大
D. 产生气泡的速率甲比乙快
【答案】D
【解析】
甲中形成铜锌原电池,锌作负极,失电子,铜作正极, H+在铜极上得电子,生成氢气,总反应式为:Zn+H2SO4=ZnSO4+H2↑,乙装置中只是锌片与稀硫酸间发生了置换反应: Zn+H2SO4=ZnSO4+H2↑,没有电流产生,以此进行分析。
甲中形成铜锌原电池,锌作负极,失电子,铜作正极, H+在铜极上得电子,生成氢气,所以甲中铜片表面有气泡产生,A错误;乙中不构成原电池,铜片不是电极,B错误;甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,C错误;甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,D正确;正确选项D。

 阅读快车系列答案
阅读快车系列答案【题目】某学生为了探究影响化学反应速率的外界因素,进行以下实验。
(1)向100mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
①在0~1、1~2、2~3、3~4、4~5min各时间段中:
反应速率最大的时间段是________min,主要的原因可能是_____________________;
反应速率最小的时间段是________min,主要的原因可能是_____________________。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入________(填序号)。
a.蒸馏水 b.NaOH溶液 c.NaNO3溶液 d.Na2CO3溶液
(2)进行以下对比实验并记录实验现象。
实验 Ⅰ
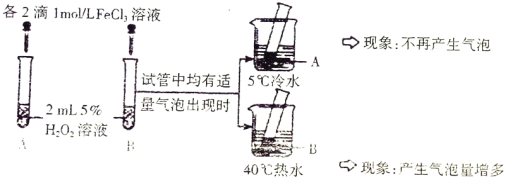
实验 Ⅱ:另取两支试管分别加入5mL5%eH2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡
产生。
①双氧水分解的化学方程式是________________。
②实验 Ⅰ 的目的是______________。
③实验 Ⅱ 未观察到预期现象,为了达到该实验的目的,可采取的改进措施是__________________。