��Ŀ����
����Ŀ����ҵ������NH3��CO2Ϊԭ�Ϻϳ����أ���Ӧ�Ļ�ѧ����ʽΪ��
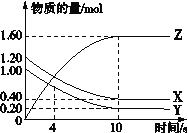
2NH3 (g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)��T1��ʱ����2L���ܱ������г���NH3��CO2ģ�ҵ������
CO(NH2)2(l)+H2O(l)��T1��ʱ����2L���ܱ������г���NH3��CO2ģ�ҵ������
��1�����ܱ������г���NH3��CO2��һ���������Է����е�ԭ����___________��
��2����ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼�ȣ�![]() ������ͼ��CO2ƽ��ת���ʣ������백̼�ȣ�x���Ĺ�ϵ��������������ʱ��������x����������ԭ����_________��
������ͼ��CO2ƽ��ת���ʣ������백̼�ȣ�x���Ĺ�ϵ��������������ʱ��������x����������ԭ����_________��

��3����x = 2��������Ӧ��5minʱ�����ʵ�Ũ�Ȳ��ٷ����仯������ʼ��ѹǿΪP0KPa�����ƽ����ϵѹǿΪ��ʼʱ��2/3����Ӧ��������õ�90g���ء�
���Լ���÷�Ӧ��ƽ������v (CO2)=_______________��
�ڸ÷�Ӧ��ƽ�ⳣ��K =_________��
�۴ﵽƽ���NH3 �����ʵ���Ũ��Ϊ_________��
���𰸡� ��Ȼ��S<0��ʹ��Ӧ���Է�������H<0ʹ��Ӧ�Է���Ӱ��̶ȴ���G<0������������������ x�����൱��c(NH3)����CO2ת�������� 0.15mol/L 0.074 3mol/L
����������1��2NH3(g)��CO2(g) ![]() CO(NH2)2(l)��H2O(l) ��H<0�����ݡ�G=��H-T��S<0ʱ�Է����У���Ӧ�ڡ�S<0����H<0ʱҪ���Է����У������ڵ��·�Ӧ�����Է����У�������Ȼ��S<0��ʹ��Ӧ���Է�������H<0ʹ��Ӧ�Է���Ӱ��̶ȴ���(2) ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼����
CO(NH2)2(l)��H2O(l) ��H<0�����ݡ�G=��H-T��S<0ʱ�Է����У���Ӧ�ڡ�S<0����H<0ʱҪ���Է����У������ڵ��·�Ӧ�����Է����У�������Ȼ��S<0��ʹ��Ӧ���Է�������H<0ʹ��Ӧ�Է���Ӱ��̶ȴ���(2) ԭ�����е�NH3��CO2�����ʵ���֮�ȣ���̼����![]() =x��xԽ���൱�ڼ���İ�������Խ�ࣻ���ַ�Ӧ����Ӱ�����Ũ�ȣ�ƽ�����ƣ�������̼��ת����������x�����൱��c(NH3)����CO2ת��������
=x��xԽ���൱�ڼ���İ�������Խ�ࣻ���ַ�Ӧ����Ӱ�����Ũ�ȣ�ƽ�����ƣ�������̼��ת����������x�����൱��c(NH3)����CO2ת��������
��3������õ�90g���أ����ص���Ϊ1.5mol��
2NH3 (g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
��ʼ��2a a 0 0
�仯��2x x 1.5
ƽ�⣺2a-2x a-x 1.5
��ѹǿ֮�ȵ������ʵ���֮�ȣ�![]() =
=![]() �����x=
�����x=![]() �������ݷ�Ӧ�ж�����̼���ĵ���Ϊ�������ɵ����ɵ�x=1.5mol������a=4.5mol��v(CO2)=
�������ݷ�Ӧ�ж�����̼���ĵ���Ϊ�������ɵ����ɵ�x=1.5mol������a=4.5mol��v(CO2)=![]() =0.15molL-1min-1����ƽ��ʱ�����Ͷ�����̼�����ʵ���Ũ�ȷֱ�Ϊ��
=0.15molL-1min-1����ƽ��ʱ�����Ͷ�����̼�����ʵ���Ũ�ȷֱ�Ϊ��![]() mol/L =3mol/L��
mol/L =3mol/L��![]() mol/L =1.5mol/L���÷�Ӧ��ƽ�ⳣ��Ϊ��K=
mol/L =1.5mol/L���÷�Ӧ��ƽ�ⳣ��Ϊ��K=![]() =0.074L3mol-3���۴ﵽƽ���NH3 �����ʵ���Ũ��Ϊ��
=0.074L3mol-3���۴ﵽƽ���NH3 �����ʵ���Ũ��Ϊ��![]() mol/L =3mol/L��
mol/L =3mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����l����������ʵ�У�ʲô����Ӱ���˻�ѧ��Ӧ�����ʣ�
�����ڵ�KClO3�ų����ݺ�������������MnO2�ܿ��������______��
��ͬŨ�ȡ�ͬ����������з���ͬ����С��п����þ�������������п�����______��
��KI�����HgCl2�����Ϻ�������������һ��Ͷ��ˮ�У��ܿ����ɺ�ɫHgI2______��
��2��ij̽��С���ò���HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء���ѡ�Լ���1.00 mol/LHNO3��2.00 mol/LHNO3��ϸ��������ʯ���ֿ�������ʯ��35��ˮԡ��
��������ܽ��е�̽�����ݣ���д����ʵ����Ʊ������̽��ʵ�飺
ʵ���� | T�� | ����ʯ��� | HNO3Ũ�ȣ�mol/L�� |
A | ���� | 2.00 | |
B | �ֿ��� | 1.00 | |
C | �ֿ��� | 2.00 | |
D | ϸ���� | 2.00 |
������ʵ����Ӧ���ƵIJ�������������Һ�����______��
�۸�ʵ��С��������ͼʵ��װ�ý���ʵ�顣

a����������ƽ������ܡ���ƿ��ҩ�ס������������⣬�����ʵ����������______��
b������Ӧ��ʼʱ������ƽ����Ϊ100.00g����2���ӷ�Ӧ����ʱ�Ķ���Ϊ95.60g����������������CaCO3����ʾ������Ϊ_____g/min��
c�������������װ�ã���������______������ƫ��������ƫС����������������