ЬтФПФкШн
ЁОЬтФПЁПЃЈ1ЃЉдкБъзМзДПіЯТЃЌЯТСаЮяжЪЃКЂй4 g H2ЃЌЂк33.6 L CH4ЃЌЂл1.6 mol H2OЃЌЦфжаЫљКЌЗжзгЪ§зюЖрЕФЪЧ__________ЃЈЬюађКХЃЌЯТЭЌЃЉЃЛЬхЛ§зюаЁЕФЪЧ_________ЁЃ
ЃЈ2ЃЉ15.6 g Na2R2жаКЌ0.4 molЕФNaЃЋЃЌдђRЕФЯрЖддзгжЪСПЪЧ___________ЃЛдкNa2R2жаRЕФжЪСПЪЧ3.2 g ЪБЃЌЦфNa2R2ЕФЮяжЪЕФСПЪЧ_____________ЁЃ
ЃЈ3ЃЉ10 g NaOHШмНтдк___________ gЫЎжаЃЌВХФмЪЙУП10 ИіЫЎЗжзгжаШмга1ИіNa+ЃЛДЫЪБШмвКжаШмжЪЕФЮяжЪЕФСПХЈЖШЮЊ______________ЁЃ(ЩшШмвКЕФУмЖШЮЊ1.1g/cm3)
ЁОД№АИЁП Ђй Ђл 16 0.1 mol 45 5 mol/L
ЁОНтЮіЁПЃЈ1ЃЉЂй4gH2ЕФnЃЈH2ЃЉ=2molЃЌNЃЈH2ЃЉ=2NAЃЌvЃЈH2ЃЉ=44.8LЃЛЂкБъзМзДПіЯТ33.6L CH4ЕФnЃЈCH4ЃЉ=![]() =1.5molЃЌNЃЈCH4ЃЉ=1.5NAЃЛЂл1.6molH2OЕФЗжзгЪ§ЮЊNЃЈH2OЃЉ=1.6NAЃЌЬхЛ§дМЮЊ18mLЃЛзлЩЯЗжЮіПЩжЊЃЌКЌЗжзгЪ§зюЖрЕФЪЧЂйЃЌЬхЛ§зюаЁЕФЂлЃЛ(2) 1 mol Na2R2жаКЌгаNaЃЋ 2 molЃЌR2Ѓ 1 molЃЌЙЪКЌга0.4 mol NaЃЋЕФNa2R2ЕФЮяжЪЕФСПгІЮЊ0.2 molЁЃФЧУДM(Na2R2)ЃН
=1.5molЃЌNЃЈCH4ЃЉ=1.5NAЃЛЂл1.6molH2OЕФЗжзгЪ§ЮЊNЃЈH2OЃЉ=1.6NAЃЌЬхЛ§дМЮЊ18mLЃЛзлЩЯЗжЮіПЩжЊЃЌКЌЗжзгЪ§зюЖрЕФЪЧЂйЃЌЬхЛ§зюаЁЕФЂлЃЛ(2) 1 mol Na2R2жаКЌгаNaЃЋ 2 molЃЌR2Ѓ 1 molЃЌЙЪКЌга0.4 mol NaЃЋЕФNa2R2ЕФЮяжЪЕФСПгІЮЊ0.2 molЁЃФЧУДM(Na2R2)ЃН![]() ЃН
ЃН![]() ЃН78 g/molЃЌM(R)ЃН
ЃН78 g/molЃЌM(R)ЃН![]() ЃН16 g/molЃЌRЕФЯрЖддзгжЪСПЪЧ16ЃЛЙЪ3.2 g RЕФЮяжЪЕФСПЮЊn(R)ЃН
ЃН16 g/molЃЌRЕФЯрЖддзгжЪСПЪЧ16ЃЛЙЪ3.2 g RЕФЮяжЪЕФСПЮЊn(R)ЃН![]() ЃН0.2 molЃЌЫљвдn(Na2R2)ЃН
ЃН0.2 molЃЌЫљвдn(Na2R2)ЃН![]() n(R)ЃН0.1 molЃЛЃЈ3ЃЉnЃЈNaOHЃЉ=
n(R)ЃН0.1 molЃЛЃЈ3ЃЉnЃЈNaOHЃЉ=![]() =0.25molЃЌвЊЪЙУП10ИіЫЎЗжзгжаШмгавЛИіФЦРызгЃЌдђЫЎЕФЮяжЪЕФСПгыЧтбѕЛЏФЦЕФЮяжЪЕФСПжЎБШЮЊ10ЃК1ЃЌЫЎЕФжЪСПm=nM=0.25molЁС10ЁС18g/mol=45gЃЌдђЫљЕУШмвКжаNaOHЕФжЪСПЗжЪ§ЮЊ
=0.25molЃЌвЊЪЙУП10ИіЫЎЗжзгжаШмгавЛИіФЦРызгЃЌдђЫЎЕФЮяжЪЕФСПгыЧтбѕЛЏФЦЕФЮяжЪЕФСПжЎБШЮЊ10ЃК1ЃЌЫЎЕФжЪСПm=nM=0.25molЁС10ЁС18g/mol=45gЃЌдђЫљЕУШмвКжаNaOHЕФжЪСПЗжЪ§ЮЊ![]() ЁС100%=
ЁС100%=![]() ЃЌШмНтКѓШмвКЕФУмЖШЮЊ1.1g/mLЃЌЧтбѕЛЏФЦЕФжЪСПЗжЪ§ЮЊ
ЃЌШмНтКѓШмвКЕФУмЖШЮЊ1.1g/mLЃЌЧтбѕЛЏФЦЕФжЪСПЗжЪ§ЮЊ![]() ЃЌдђcЃЈNaOHЃЉ=
ЃЌдђcЃЈNaOHЃЉ=![]() =
=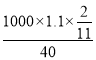 mol/L=5mol/LЁЃ
mol/L=5mol/LЁЃ
