题目内容
7.有四种短周期元素,它们的结构、性质等信息如下表所述:| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式
1s22s22p63s1.
(2)B元素在周期表中的位置第三周期第ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是
 .
.(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O_,与D的氢化物的水化物反应的化学方程式为3HCl+Al(OH)3═AlCl3+3H2O.
分析 A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,所以A为Na元素;
B与A同周期,其最高价氧化物的水化物呈两性,则B为Al元素;
C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;
D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl元素,据此进行答题.
解答 解:A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,所以A为Na元素;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al元素;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl元素,
(1)A为钠元素,A原子的核外电子排布式1s22s22p63s1,
故答案为:1s22s22p63s1;
(2)B为铝元素,B元素在周期表中的位置第三周期第ⅢA族,电子层数相同的离子,核电荷数越大,离子半径半径越小,所以铝离子半径小于钠离子,
故答案为:第三周期第ⅢA族;小于;
(3)C为氮元素,C原子的基态原子的电子排布图是 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃,
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃,
故答案为: ;3;2p;哑铃;
;3;2p;哑铃;
(4)D为氯元素,氯原子核外电子排布式为:1s22s22p63s23p5或[Ne]3s23p5;Cl-的结构示意图为 ,
,
故答案为:1s22s22p63s23p5或[Ne]3s23p5; ;
;
(5)B为铝元素,D为氯元素,B的最高价氧化物对应的水化物与D的最高价氧化物的水化物反应的化学方程式为:Al(OH)3+3HClO4═Al(ClO4)3+3H2O;D的氢化物HCl,氯化氢与氢氧化铝反应的离子方程式为:3HCl+Al(OH)3═AlCl3+3H2O,
故答案为:Al(OH)3+3HClO4═Al(ClO4)3+3H2O;3HCl+Al(OH)3═AlCl3+3H2O.
点评 本题考查了位置、结构与性质关系的综合应用,正确推断各元素名称为解答关键,试题知识点较多、综合性较强,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案| A. | F- | B. | NH3 | C. | H2O | D. | Na+ |
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量,②最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
| A. | 沼气和液化石油气都是可再生能源 | |
| B. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| C. | PM 2.5含有的铅、铬、砷等对人体有害的元素均是重金属元素 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白体发生变性 |
| A. | 利用沸点数据可以推测将一些液体混合物分离开来的可能性 | |
| B. | 通过比较溶度积常数(Ksp)与溶液中有关离子浓度幂的乘积--离子积(Qc)的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解 | |
| C. | 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性 | |
| D. | 根据分散质粒子直径的大小,可以判断分散系的类别 |
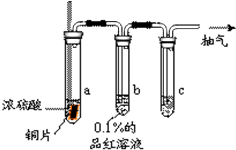 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(如图,图中夹持仪器和加热仪器没有画出).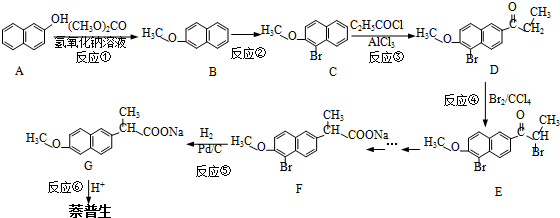
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是 .
.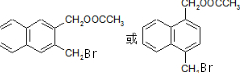 (任写一种).
(任写一种). 的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)