ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ“Μ÷÷ΗΏΖ÷Ή”Μ·ΚœΈοΘ®ΔωΘ© «ΡΩ«Α –≥Γ…œΝς––ΒΡ«ΫΟφΆΩΝœ÷°“ΜΘ§ΤδΚœ≥…¬ΖœΏ»γœ¬Θ®Ζ¥”ΠΨυ‘Ύ“ΜΕ®ΧθΦΰœ¬Ϋχ––Θ©ΘΚ

ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©Μ·ΚœΈοI÷–ΥυΚ§ΙΌΡήΆ≈ΒΡΟϊ≥Τ «_____________Θ§”…CH2=CH2…ζ≥…Μ·ΚœΈοΔώΒΡΖ¥”Πάύ–Ά «__________ΓΘ
Θ®2Θ©Ζ÷±π–¥≥ωΚœ≥…œΏ¬Ζ¥”Μ·ΚœΈοΔώΒΫΔρΓΔ¥”Μ·ΚœΈοΔτΒΫΔθΒΡΜ·―ßΖΫ≥Χ Ϋ_______________________________ΓΔ_______________________________ΓΘ
Θ®3Θ©Μ·ΚœΈοΔσ‘Ύ“ΜΕ®ΧθΦΰœ¬Ω……ζ≥…ΜΖΉ¥Μ·ΚœΈοC3H4O2Θ§«κ–¥≥ωΗΟΜ·ΚœΈοΒΡΫαΙΙΦρ Ϋ_______________ΓΘ
Θ®4Θ©œ¬Ν–ΙΊ”ΎΜ·ΚœΈοΔσΓΔΔτΚΆΔθΒΡΥΒΖ®÷–Θ§’ΐ»ΖΒΡ «_____________ΓΘ
AΘ°Μ·ΚœΈοΔσΩ…“‘ΖΔ…ζ―θΜ·Ζ¥”Π
BΘ°Μ·ΚœΈοΔσ≤ΜΩ…“‘”κNaOH»ή“ΚΖ¥”Π
CΘ°Μ·ΚœΈοΔτΡή”κ«βΤχΖΔ…ζΦ”≥…Ζ¥”Π
DΘ°Μ·ΚœΈοΔσΓΔΔτΨυΩ…”κΫπ τΡΤΖ¥”Π…ζ≥…«βΤχ
EΘ°Μ·ΚœΈοΔτΚΆΔθΨυΩ…“‘ ΙδεΒΡΥΡ¬»Μ·ΧΦ»ή“ΚΆ …Ϊ
Θ®5Θ©”κΜ·ΚœΈοVΨΏ”–œύΆ§ΙΌΡήΆ≈ΒΡVΒΡΆ§Ζ÷“λΙΙΧε”–_________÷÷Θ®≤ΜΑϋά®Μ·ΚœΈοV±Ψ…μΘ§«“≤ΜΩΦ¬«ΝΔΧε“λΙΙΘ©ΓΘ
ΓΨ¥πΑΗΓΩτ«ΜυΓΔ¬»‘≠Ή” Φ”≥…Ζ¥”Π CH2(OH)CH2Cl + HCN ![]() CH2(OH)CH2CN + HCl CH2=CH-COOH + CH3OH
CH2(OH)CH2CN + HCl CH2=CH-COOH + CH3OH ![]() CH2=CH-COOCH3+H2O
CH2=CH-COOCH3+H2O ![]() ACDE 4
ACDE 4
ΓΨΫβΈωΓΩ
ΗυΨίΝς≥ΧΩ…÷ΣΘ§““œ©”κ¥Έ¬»ΥαΖΔ…ζΦ”≥…Ζ¥”ΠΘ§…ζ≥…CH2Cl-CH2OHΘ§‘Ό”κHCNΖ¥”Π…ζ≥…NC-CH2-CH2OHΘ§‘Ό…ζ≥…CH2Θ®OHΘ©-CH2-COOHΘ§‘ΌΖΔ…ζœϊ»ΞΖ¥”Π…ζ≥…CH2=CH-COOHΘ§”κΦΉ¥ΦΖΔ…ζθΞΜ·Ζ¥”Π…ζ≥…CH2=CH-COOCH3Θ§ΉνΚσΖΔ…ζΦ”ΨέΖ¥”Π…ζ≥…![]() ΓΘ
ΓΘ
Θ®1Θ©Μ·ΚœΈοIΈΣCH2Cl-CH2OHΘ§ΥυΚ§ΙΌΡήΆ≈ΒΡΟϊ≥ΤΈΣτ«ΜυΓΔ¬»‘≠Ή”ΘΜΖ¥”ΠI÷–““œ©÷–ΒΡΥΪΦϋ±δΈΣΒΞΦϋΘ§Ζ¥”Πάύ–ΆΈΣΦ”≥…Ζ¥”ΠΘΜ
Θ®2Θ©CH2Cl-CH2OH”κHCNΖΔ…ζ»Γ¥ζΖ¥”Π…ζ≥…NC-CH2-CH2OHΚΆHClΘ§ΖΫ≥Χ ΫΈΣCH2(OH)CH2Cl + HCN ![]() CH2(OH)CH2CN + HClΘΜCH2=CH-COOH”κΦΉ¥ΦΖΔ…ζθΞΜ·Ζ¥”Π…ζ≥…CH2=CH-COOCH3ΚΆΥ°Θ§ΖΫ≥Χ ΫΈΣCH2=CH-COOH + CH3OH
CH2(OH)CH2CN + HClΘΜCH2=CH-COOH”κΦΉ¥ΦΖΔ…ζθΞΜ·Ζ¥”Π…ζ≥…CH2=CH-COOCH3ΚΆΥ°Θ§ΖΫ≥Χ ΫΈΣCH2=CH-COOH + CH3OH ![]() CH2=CH-COOCH3+H2OΘΜ
CH2=CH-COOCH3+H2OΘΜ
Θ®3Θ©Μ·ΚœΈοΔσΈΣCH2Θ®OHΘ©-CH2-COOHΘ§“ΜΕ®ΧθΦΰœ¬Ή‘…μΖΔ…ζθΞΜ·Ζ¥”Π…ζ≥…ΜΖΉ¥Μ·ΚœΈοΘ§ΫαΙΙΦρ ΫΈΣ![]() ΘΜ
ΘΜ
Θ®4Θ©Μ·ΚœΈοΔσΈΣCH2Θ®OHΘ©-CH2-COOHΘ§Κ§”–ΒΡΙΌΡήΆ≈ΈΣτ«ΜυΓΔτ»ΜυΘ§Ω…”κNaΓΔ¥ΦΓΔΥαΖΔ…ζΖ¥”ΠΘ§Ω…”κNaOHΖ¥”ΠΘ§Ω…ΖΔ…ζ―θΜ·Ζ¥”ΠΘ§Ρή ΙΥα–‘ΗΏΟΧΥαΦΊ»ή“ΚΆ …ΪΘΜΔτΈΣCH2=CH-COOHΘ§Κ§”–ΧΦΧΦΥΪΦϋΓΔτ»ΜυΘ§Ω…ΖΔ…ζΦ”ΨέΖ¥”ΠΓΔΦ”≥…Ζ¥”ΠΓΔ―θΜ·Ζ¥”ΠΘ§Ω…”κ¥ΦΖΔ…ζθΞΜ·Ζ¥”ΠΘ§”κNaOHΖΔ…ζ÷–ΚΆΖ¥”ΠΘ§”κNaΖ¥”Π…ζ≥…«βΤχΘΜΔθΈΣCH2=CH-COOCH3Θ§Ω…ΖΔ…ζΦ”ΨέΖ¥”ΠΓΔΦ”≥…Ζ¥”ΠΓΔ―θΜ·Ζ¥”ΠΘ§ΖΔ…ζθΞΒΡΥ°ΫβΖ¥”ΠΘΜ‘ρ¥πΑΗΈΣACDEΘΜ
Θ®5Θ©Μ·ΚœΈοVΈΣCH2=CH-COOCH3Θ§Κ§”–ΧΦΧΦΥΪΦϋΓΔθΞΜυΒΡΆ§Ζ÷“λΙΙΧεΈΣCH3COOCH=CH2Θ§HCOOCH=CHCH3Θ§HCOOCΘ®CH3Θ©=CH2Θ§HCOO CH2CH=CH2Θ§ΚœΦΤ4÷÷ΓΘ

ΓΨΧβΡΩΓΩ‘ΎΜ®ΤΩ÷–Φ”»κΓΑœ Μ®±Θœ ΦΝΓ±Θ§Ρή―”≥Λœ Μ®ΒΡ ΌΟϋΓΘ
Θ®1Θ©œ÷”–“Μ÷÷Έό…ΪΒΡœ Μ®”Σ―χ“ΚΘ§Ω…Ρή”…œθΥαΗΤΓΔΧΦΥαΦΊΓΔœθΥαΦΊΓΔ¬»Μ·ΦΊ÷–ΒΡ“Μ÷÷ΜρΦΗ÷÷Έο÷ Ήι≥…Θ§ΈΣΧΫΨΩΤδ≥…Ζ÷Θ§Ρ≥Ά§―ß…ηΦΤ≤ΔΆξ≥…ΝΥ»γœ¬ΆΦΥυ ΨΒΡ Β―ιΓΘ
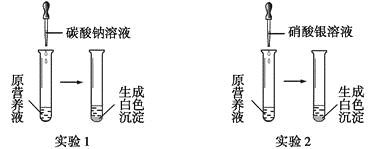
ΗυΨί“‘…œ Β―ιΘ§«κΡψΧνΩ’ΓΘ
ΔΌ”… Β―ι1Ω…»ΖΕ®‘≠”Σ―χ“Κ÷–“ΜΕ®ΟΜ”–ΒΡΈο÷ «__________(ΧνΜ·―ß Ϋ)Θ§–¥≥ω…ζ≥…ΑΉ…Ϊ≥ΝΒμΒΡάκΉ”ΖΫ≥Χ Ϋ «________________________ΓΘ
ΔΎ»τ≤βΒΟ‘≠”Σ―χ“Κ÷–K+ΓΔCl-ΒΡ ΐΡΩ÷°±»ΈΣ2ΓΟ1Θ§‘ρ‘≠”Σ―χ“Κ «”…____÷÷»ή÷ ≈δ÷Τ≥…ΒΡΓΘ
ΔέΡ≥Ά§―ß”Ο¬»Μ·ΗΤΓΔœθΥαΦΊΓΔ¬»Μ·ΦΊ≈δ≥…ΒΡ”Σ―χ“Κ÷–K+ΓΔCl-ΓΔNO3-ΒΡ ΐΡΩ÷°±»ΈΣ2ΓΟ5ΓΟ1Θ§‘ρΥυ”ΟœθΥαΦΊΚΆ¬»Μ·ΗΤΒΡΈο÷ ΒΡΝΩ÷°±» «__________ΓΘ
Θ®2Θ©œ¬±μ «500mLΡ≥ΓΑœ Μ®±Θœ ΦΝΓ±÷–Κ§”–ΒΡ≥…Ζ÷Θ§‘ΡΕΝΚσΜΊ¥πœ¬Ν–Έ ΧβΓΘ
≥…Ζ÷ | ÷ ΝΩΘ®gΘ© | ΡΠΕϊ÷ ΝΩΘ®g ΓΛmol-1Θ© |
’αΧ« | 68.4 | 342 |
ΝρΥαΦΊ | 0.50 | 174 |
ΑΔΥΨΤΞΝ÷ | 0.35 | 180 |
ΗΏΟΧΥαΦΊ | 0.50 | 158 |
œθΥα“χ | 0.04 | 170 |
ΔΌΓΑœ Μ®±Θœ ΦΝΓ±÷–’αΧ«ΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ___________________ΓΘ
ΔΎ≈δ÷ΤΗΟ500mL ΓΑœ Μ®±Θœ ΦΝΓ±Υυ–ηΒΡ≤ΘΝß“«Τς≥ΐΝΥ…’±≠ΓΔ≤ΘΝßΑτΓΔΝΩΆ≤ΆβΜΙ”–________ΓΘ
Δέ‘Ύ»ή“Κ≈δ÷ΤΙΐ≥Χ÷–Θ§œ¬Ν–≤ΌΉςΡή Ι≈δ÷ΤΫαΙϊΤΪ–ΓΒΡ «___________ΓΘ
AΘ°Ε®»ί ±―ω ”»ίΝΩΤΩΩΧΕ»œΏ
BΘ°»ίΝΩΤΩ‘Ύ Ι”Ο«ΑΈ¥Η…‘οΘ§άοΟφ”–…ΌΝΩ’τΝσΥ°
CΘ°“Τ“Κ ±Θ§“ΚΧε≤Μ–Γ–Ρ¥”Άβ±ΎΝς≥ω
DΘ°Ε®»ί“Γ‘»ΚσΖΔœ÷“ΚΟφΒΆ”Ύ»ίΝΩΤΩΒΡΩΧΕ»œΏΘ§ΒΪΈ¥Ήω»ΈΚΈ¥Πάμ
ΓΨΧβΡΩΓΩ‘Ύ10 LΚψ»ίΟή±’»ίΤς÷–≥δ»κX(g)ΚΆY(g)Θ§ΖΔ…ζΖ¥”ΠX(g)ΘΪY(g) ![]() M(g)ΘΪN(g)Θ§ΥυΒΟ Β―ι ΐΨί»γœ¬±μΘΚ
M(g)ΘΪN(g)Θ§ΥυΒΟ Β―ι ΐΨί»γœ¬±μΘΚ
Β―ι ±ύΚ≈ | Έ¬Ε»/Γφ | Τπ Φ ±Έο÷ ΒΡΝΩ/mol | ΤΫΚβ ±Έο÷ ΒΡΝΩ/mol | ||
n(X) | n(Y) | n(M) | |||
ΔΌ | 700 | 0.40 | 0.10 | 0.090 | |
ΔΎ | 800 | 0.10 | 0.40 | 0.080 | |
Δέ | 800 | 0.20 | 0.30 | a | |
Δή | 900 | 0.10 | 0.15 | b | |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «(ΓΓΓΓ)
A. Β―ιΔΌ÷–Θ§»τ5 min ±≤βΒΟn(M)ΘΫ0.050 molΘ§‘ρ0÷Ν5 min ±ΦδΡΎΘ§”ΟN±μ ΨΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(N)ΘΫ1.0ΓΝ10Θ≠2 molΓΛLΘ≠1ΓΛminΘ≠1
B. Β―ιΔΎ÷–Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐKΘΫ2.0
C. Β―ιΔέ÷–Θ§¥οΒΫΤΫΚβ ±Θ§XΒΡΉΣΜ·¬ ΈΣ60%
D. Β―ιΔή÷–Θ§¥οΒΫΤΫΚβ ±Θ§b>0.060