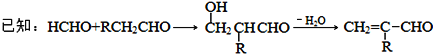
题目内容
【题目】(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g);ΔH=-681.8kJ·mol1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=___________;②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是____________(填字母)。
A.加入一定量的粉状碳酸钙B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
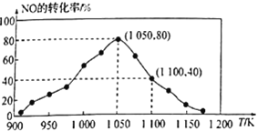
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为___________,在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________(已知:气体分压(P分)=气体总压(Pa)×体积分数)
(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2
N2(g)+2CO2
①达到平衡后,仅升高温度,k正增大的倍数____________ (填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() = ____________。
= ____________。
【答案】0.021mol·L-1·min-1 BC 1050K前反应末达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 4 < ![]()
【解析】
(1)①结合v=△c/△t计算;
②30min后,反应物、生成物浓度均增大;
(2)由图可知1050K前反应末达到平衡状态,在1050K、1.1×106Pa时,NO的转化率为80%,设NO起始量为1mol·L-1,则
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
开始 1 0 0
转化 0.8 0.4 0.4
平衡 0.2 0.4 0.4
气体分压(P分)=气体总压(Pa)×体积分数,以此计算Kp;
(3)①焓变为负,为放热反应,升高温度平衡逆向移动;
②在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
开始 1 1 0 0
转化 0.4 0.4 0.2 0.4
平衡 0.6 0.6 0.2 0.4
平衡时v正=v逆,即k正/k逆=c(N2)c2(CO2)/c2(NO)c2(CO)。
(1)①0~10min内,平均反应速率v(O2)=(1mol·L-1-0.79mol·L-1)÷10min=0.021mol·L-1·min-1;
②由表中数据可知,30min后,反应物、生成物浓度均增大,则改变条件为通入一定量的O2或适当缩小容器的体积,
故选:BC;
(2)由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为1050K前反应末达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;
在1050K、1.1×106Pa时,NO的转化率为80%,设NO起始量为1mol·L-1,则
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
开始 1 0 0
转化 0.8 0.4 0.4
平衡 0.2 0.4 0.4
Kp=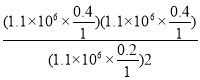 =4
=4
(3)①焓变为负,为放热反应,升高温度平衡逆向移动,则仅升高温度,k正增大的倍数<k逆增大的倍数;
②在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
开始 1 1 0 0
转化 0.4 0.4 0.2 0.4
平衡 0.6 0.6 0.2 0.4
平衡时v正=v逆,即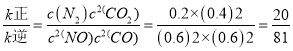 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列反应中的能量转化不正确的是( )
选项 | 化学反应 | 能量转化形式 |
A | CH4+2O2 | 化学能转化成热能 |
B | Pb+PbO2+2H2SO4 | 使用时放电,电能转化成化学能 |
C | mH2O+nCO2 | 光能转化成化学能 |
D | CaCO3 | 热能转化成化学能 |
A.AB.BC.CD.D