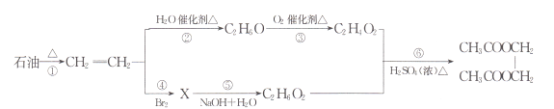
题目内容
【题目】某溶液中只可能含有下列离子中的几种:K+、NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]() (不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;(已知NH4+在碱性条件下可以生产氨气)
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
下列说法正确的是( )
A. 该溶液中无法确定是否含有K+
B. 该溶液中肯定含有NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]()
C. 不能确定该溶液中是否含有NO![]()
D. 该溶液中一定含K+,且c(K+)= 0.1mol/L
【答案】C
【解析】
实验1,加入足量NaOH溶液并加热产生气体,溶液中一定存在NH4+,n(NH4+)=n(NH3)=![]() =0.01mol;实验2,加入盐酸无现象,再加入足量BaCl2溶液产生固体,溶液中不含CO32-,含有SO42-,n(SO42-)=n(BaSO4)=
=0.01mol;实验2,加入盐酸无现象,再加入足量BaCl2溶液产生固体,溶液中不含CO32-,含有SO42-,n(SO42-)=n(BaSO4)=![]() =0.01mol;根据溶液中的电荷守恒,溶液中一定含K+,无法确定是否含NO3-,若不含NO3-,根据电荷守恒,n(K+)=2n(SO42-)-n(NH4+)=0.01mol,若含NO3-,n(K+)
=0.01mol;根据溶液中的电荷守恒,溶液中一定含K+,无法确定是否含NO3-,若不含NO3-,根据电荷守恒,n(K+)=2n(SO42-)-n(NH4+)=0.01mol,若含NO3-,n(K+)![]() 0.01mol;对照各选项,正确的是C,答案选C。
0.01mol;对照各选项,正确的是C,答案选C。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为_____________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ΔH>0,请你分析该设想能否实现并说明理由是____________________________________________。
(3)甲酸的电离平衡常数Ka=1.70×10-4。向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为______________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
(5)工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_______________________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是____________________________。