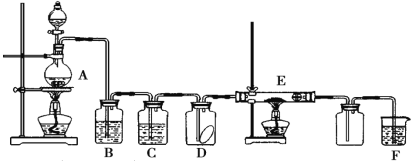
题目内容
【题目】有一无色溶液,其中可能含有 Fe3+、Al2+ 、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其探作和有关现象如下图所示:
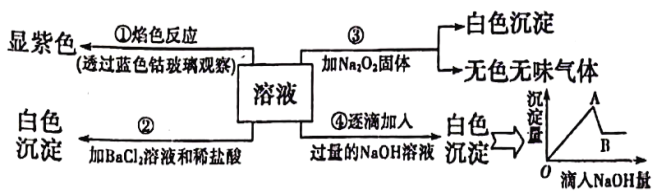
请你根据上图推断:
(1)原溶液中一定存在的阴离子有(写化学式):_________________________。
(2)写出实验④中产生的沉淀有:______________________。
写出由A→B过程中所发生反应的离子方程式: ______________________。
(3)实验③中产生无色无味气体所发生的化学方程式为:______________________。
(4)实验②中加入稀盐酸的目的是______________________。
【答案】SO42- Al(OH)3、Mg(0H)2 Al(0H)3+0H-=Al02-+2H20 2Na202+2H20= 4Na0H+02↑ 确定白色沉淀不是碳酸钡沉淀,而是硫酸钡沉淀
【解析】
根据常见离子的颜色、焰色反应等特征性质,结合实验现象分析回答。
无色溶液中不可能含有 Fe3+(黄色)、Fe2+(淡绿色)、Cu2+(蓝色)。
(1)据实验②,原溶液中加入BaCl2溶液和稀盐酸生成的白色沉淀只能是BaSO4,一定存在的阴离子SO42-;
(2)据实验④中产生的沉淀与滴入NaOH溶液的关系图,A→B是Al(OH)3溶解,离子方程式是Al(OH)3+OH-=AlO2-+2H2O,B点后是Mg(OH)2不溶于碱,故生成的沉淀有Al(OH)3、Mg(OH)2;
(3)实验③中,Na2O2与水反应2Na2O2+2H2O= 4NaOH+O2↑,所得气体无色无味,则不含氨气,原溶液中无NH4+。
(4)BaCO3能溶于稀盐酸,而BaSO4不溶。实验②中加入稀盐酸,保证生成的白色沉淀中只有BaSO4。

【题目】二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
回答下列问题:
(1)反应①为熵___________(填“增加”或“减少”)的反应,__________ (填“低温”或“高温”)下易自发进行。
(2)写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:__________________________________。
(3)温度为500K时,在2L的密闭容器中充入2 mol CO和6 molH2发生反应①、②,5 min时达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2 mol·L-1,用H2表示反应①的速率是______________,反应②的平衡常数K=________________。
若在500K时,测得容器中n(CH3OCH3)=2n (CH3OH),此时反应②的v正__ v逆(填“>”、 “< ”或“=”)。
(4)研究发现,在体积相同的容器中加入物质的量相同的CO和H2发生反应①、②,在不同温度和有无催化剂组合下经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO转化率(%) | CH3OCH3选择性(%) |
473 | 无 | 10 | 36 |
500 | 无 | 12 | 39 |
500 | Cu/ZnO | 20 | 81 |
[备注]二甲醚选择性:转化的CO中生成CH3OCH3的百分比
①相同温度下,选用Cu/ZnO作催化剂,该催化剂能____________ (填标号)。
A.促进平衡正向移动 B.提高反应速率 C.降低反应的活化能
D.改变反应的焓变 E.提高CO的平衡转化率
②表中实验数据表明,在500K时,催化剂Cu/ZnO对CO转化成CH3OCH3的选择性有显著的影响,其原因是_________________________________________________。