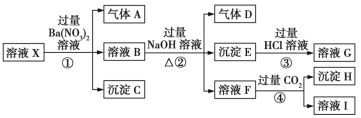
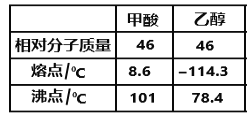
题目内容
【题目】对于元素周期表中下列位置的①~⑩10种元素,请用元素符号或化学式回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | ② | ||||||
二 | ③ | ④ | ⑤ | ⑥ | ||||
三 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑦在元素周期表中的位置____________。
(2)以上元素所形成的最高价含氧酸酸性最强的酸是____________,(填化学式,下同)碱性最强的碱是____________。它们与⑨的单质反应的离子方程式分别为____________、____________。
(3)④⑤⑥的原子半径的由大到小顺序为____________。(填元素符号)③④⑤⑥的最简单氢化物的稳定性由弱到强的顺序为____________。
(4)⑤⑦的一种1:1型化合物X的电子式为____________。X能和①⑤组成的一种化合物Y反应生成⑤的单子,则化学方程式为____________。
【答案】第3周期 第ⅠA族 HClO4 NaOH ![]()
![]() N>O>F
N>O>F ![]()
![]()
![]()
【解析】
由表知,十种元素均为主族元素,其周期序数等于原子的电子层数,主族序数等于最外层电子数,则①的原子序数为1,为氢元素,②的原子序数为2,为氦元素,③的原子序数为6,为碳元素,④的原子序数为7,为氮元素,⑤的原子序数为8,为氧元素,⑥的原子序数为9,为氟元素,⑦的原子序数为11,为钠元素,⑧的原子序数为12,为镁元素,⑨的原子序数为13,为铝元素,⑩的原子序数为17,为氯元素,结合元素周期律、元素周期表,分析回答;
(1)⑦即钠元素在元素周期表中的位置为:第3周期 第ⅠA族;
答案为:第3周期 第ⅠA族;
(2)按元素周期律知,非金属性最强的元素其最高价含氧酸酸性最强,则以上元素所形成的最高价含氧酸酸性最强的酸是HClO4,金属性最强的元素其最高价氧化物的水化物碱性最强,碱性最强的碱是NaOH,它们与⑨即Al的单质反应的离子方程式分别为![]() 、
、![]() ;
;
答案为:HClO4; NaOH;![]() ;
;![]() ;
;
(3)④⑤⑥分别为N、O、F,位于同周期,核电荷数逐渐增大,原子半径逐渐减小,故原子半径的大小顺序为N>O>F,③即碳元素,则③④⑤⑥的非金属性依次递增,其最简单氢化物的稳定性也随之递增,顺序为![]() ;
;
答案为:N>O>F;![]() ;
;
(4)⑤⑦的一种1:1型化合物X为过氧化钠,其电子式为![]() ,X能和①⑤组成的一种化合物Y反应生成⑤的单质,即过氧化钠与水反应生成氢氧化钠和氧气,则化学方程式为
,X能和①⑤组成的一种化合物Y反应生成⑤的单质,即过氧化钠与水反应生成氢氧化钠和氧气,则化学方程式为![]() ;
;
答案为:![]() ;
;![]() 。
。

【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl﹣ CO32﹣ NO3﹣ SO42﹣ SiO32﹣ |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是_____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_______。
(3)将Ⅲ中红棕色气体(标况下)收集一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为_________mol/L(精确到千分位)。
(4)甲同学最终确定原溶液中所含阳离子是___________,阴离子是_______。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为_________________,质量为_______________g。
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是____(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2△H<0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)(×10-4mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
C(CO)(×10-3mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
前2s内的平均反应速率v(N2)=______;达到平衡时,NO的转化率为_____,气相中NO所占的体积分数为______。