题目内容
【题目】某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取粗铜和绿矾(FeSO4·7H2O)产品,设计流程如下:

(1)气体a为________
(2)固体B的主要成分为____________
(3)溶液B在空气中放置有可能变质,如何检验溶液B是否变质:_________________________
(4)下列实验操作中,步骤⑤中需要用到的是________(填字母)。

(5)为测定产品中绿矾的质量分数,称取40.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.80 | 20.02 | 19.98 | 20.00 |
① 请写出有关滴定的离子方程式_____________________
② 第1组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定前尖嘴有气泡,滴定后气泡消失
d.滴定终点时俯视读数
③ 根据表中数据,计算所得产品中绿矾的质量分数为_________(保留2位有效数字)
【答案】(1)SO2(2)Fe、Cu
(3)取少量溶液B于试管中,滴加KSCN溶液,若溶液变红则溶液变质,反之则没有变质。
(4)b、c
(5)①MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O②a、c③69.50℅
【解析】
试题分析:(1)Cu2S灼烧生成氧化铜和SO2 ,所以气体a是SO2 ;固体A是氧化铜、氧化铁,氧化铜、氧化铁分别与硫酸反应生成硫酸铁、硫酸铜;硫酸铁、硫酸铜溶液中加入过量的铁生成硫酸亚铁溶液和铜,固体B的主要成分为Fe、Cu;硫酸亚铁可能被氧化为Fe3+;检验溶液是否变质的方法是取少量溶液B于试管中,滴加KSCN溶液,若溶液变红则溶液变质,反之则没有变质;硫酸亚铁溶液蒸发浓缩,降温结晶、过滤可得绿矾,步骤⑤中需要用到的是蒸发、过滤操作;(5)①KMnO4溶液与Fe2+反应的离子方程式为MnO4-+ 5Fe2+ + 8H+ = Mn2++5Fe3++4H2O;第1组实验数据消耗高锰酸钾溶液的体积偏大。a.酸式滴定管用蒸馏水洗净后未用标准液润洗 ,溶液浓度偏小,消耗标准液体积偏大,a正确;
b.锥形瓶洗净后未干燥 ,无影响,b错误;
c.滴定前尖嘴有气泡,滴定后气泡消失,消耗标准液体积偏大,c正确;
d.滴定终点时俯视读数,消耗标准液体积偏小,d错误;
③设25.00mL溶液中含Fe2+ xmol
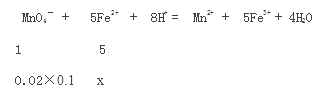
X=0.01mol,绿矾的质量分数![]() 69.50℅。
69.50℅。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案