题目内容
【题目】某工业废液主要成分为SiO2、FeO、Fe2O3、Al2O3 等,为综合利用,对其进行如下处理,制备Al2O3及(NH4)2Fe(SO4)2·6H2O。
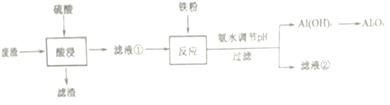
相关数据如下:
Kb(NH3·H2O) | 1.8×10-5 | 溶解度/g | 10℃ | 30℃ | 50℃ |
Ksp[A1(OH)3] | 1.3×10-33 | (NH4)2SO4 | 73.0 | 78.0 | 84.5 |
Ksp[Fe(OH)2] | 8.0×10-16 | FeSO4·7H2O | 40.0 | 60.0 | |
Ksp[Fe(OH)3] | 4.0×10-38 | |(NH4)2Fe(SO4)2·6H2O | 18.1 | 24.5 | 31.3 |
(1)酸浸过程中产生的滤渣的主要成分是_______________。
(2)滤液①中加入铁粉的作用是__________________。
(3)已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02 mol/L、0.16mol/L、0.04mol/L,加人氨水后,溶液的体积刚好增加1倍。为防止Fe2+ 产生沉淀,则溶液中的pH不能超过_______,此时溶液中n(NH3·H2O):n(NH4+)≤_____________;若调节溶液pH为5,则溶液中所有离子的物质的量浓度由大到小排列的顺序是_________________。
(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O 晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的______________,再蒸发浓缩、__________、过滤、__________、干燥。
【答案】 SiO2 将溶液中的Fe3+还原成Fe2+,使调节pH时只沉淀Al3+ 7 1∶180 c(SO![]() )>c(Fe2+)>c(NH)>c(H+)>c(Al3+)>c(OH-) (NH4)2SO4 冷却结晶 洗涤
)>c(Fe2+)>c(NH)>c(H+)>c(Al3+)>c(OH-) (NH4)2SO4 冷却结晶 洗涤
【解析】(1)SiO2不溶液于硫酸,故酸浸过程中产生的滤渣的主要成分是SiO2;(2)滤液①中加入铁粉的作用是将溶液中的Fe3+还原成Fe2+,使调节pH时只沉淀Al3+;(3)Ksp[Fe(OH)2]=c(Fe2+)c2(OH-)=![]() ×c2(OH-)= 8.0×10-16,则c(OH-)= 1.0×10-7mol/L,c(H+)= 1.0×10-7 mol/L,为防止Fe2+产生沉淀,则溶液中的pH不能超过7; Kb(NH3·H2O)=
×c2(OH-)= 8.0×10-16,则c(OH-)= 1.0×10-7mol/L,c(H+)= 1.0×10-7 mol/L,为防止Fe2+产生沉淀,则溶液中的pH不能超过7; Kb(NH3·H2O)=![]() =
=![]() =1.8×10-5,故c(NH4+):c(NH3·H2O)=180:1,此时溶液中n(NH3·H2O):n(NH4+)≤1:180;若调节溶液pH为5,则溶液中c(H+)= 1.0×10-5 mol/L,c(OH-)= 1.0×10-9mol/L,Al3+沉淀完全,c(Al3+) 1.0×10-5mol/L,已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02mol/L、0.16mol/L、0.04mol/L,c(NH4+) =
=1.8×10-5,故c(NH4+):c(NH3·H2O)=180:1,此时溶液中n(NH3·H2O):n(NH4+)≤1:180;若调节溶液pH为5,则溶液中c(H+)= 1.0×10-5 mol/L,c(OH-)= 1.0×10-9mol/L,Al3+沉淀完全,c(Al3+) 1.0×10-5mol/L,已知加入氨水前,溶液中H+、Fe2+、Al3+的浓度分别为0.02mol/L、0.16mol/L、0.04mol/L,c(NH4+) =![]() +
+![]() =0.07mol/L,c(SO42-)=
=0.07mol/L,c(SO42-)=![]() =0.1125mol/L,c(Fe2+)=0.08mol/L,故所有离子的物质的量浓度由大到小排列的顺序是:c(SO42-)>c(Fe2+)>c(NH4+)>c(H+)>c(Al3+)>c(OH-);(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的(NH4)2SO4,再蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
=0.1125mol/L,c(Fe2+)=0.08mol/L,故所有离子的物质的量浓度由大到小排列的顺序是:c(SO42-)>c(Fe2+)>c(NH4+)>c(H+)>c(Al3+)>c(OH-);(4)由滤液②制备(NH4)2Fe(SO4)2·6H2O晶体时,为防止有(NH4)2SO4或FeSO4晶体析出,须先向滤液②中加人适量的(NH4)2SO4,再蒸发浓缩、冷却结晶、过滤、洗涤、干燥。