题目内容
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。
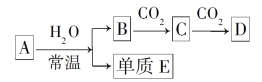
(1)若A为金属钠,A与水反应的离子方程式为_______________。
(2)若A为淡黄色的固体化合物,A________(填“是”或“不是”)碱性氧化物,A与CO2反应的化学方程式为_________________。
(3)A不论是Na还是淡黄色的固体化合物,依据转化关系判断物质C是________,物质D是________。
【答案】2Na+2H2O=2Na++2OH-+H2↑ 不是 2Na2O2+2CO2=2Na2CO3+O2 Na2CO3 NaHCO3
【解析】
(1)若A为Na,A与水反应生成单质E为H2,则B为NaOH,C为Na2CO3,D为NaHCO3;
(2)若A为Na2O2,A与水反应生成单质E为O2,则B为NaOH,C为Na2CO3,D为NaHCO3,根据碱性氧化物的定义判断物质类别;
(3)A不论是Na还是Na2O2,和水反应生成溶液为氢氧化钠溶液,通入二氧化碳反应生成C和D,判断为生成碳酸钠和碳酸氢钠。
(1)若A为Na,A与水反应生成单质E为H2,则B为NaOH,C为Na2CO3,D为NaHCO3,A与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
(2)若A为Na2O2,A与水反应生成单质E为O2,则B为NaOH,C为Na2CO3,D为NaHCO3。A与水反应产生的物质除了碱NaOH外,还有O2,反应过程中有元素化合价的变化,因此Na2O2不是碱性氧化物;A与CO2反应产生碳酸钠、氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
(3)A不论是Na还是Na2O2,和水反应生成溶液为氢氧化钠溶液,通入二氧化碳反应生成C为Na2CO3,继续通入二氧化碳反应生成D为NaHCO3。

【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
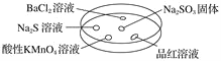
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D