题目内容
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是 ( )
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是 ( )

A. 在D点时v 正<v逆
B. 反应2SO2(g)+O2(g)![]() 2SO3(g)为放热反应
2SO3(g)为放热反应
C. 若B、C点的反应速率分别为vB、vC,则vB<vC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
【答案】A
【解析】
A、曲线上的点都是平衡点,D点SO3的百分含量低于相同温度平衡点的含量,说明D点未到达平衡状态,反应向正反应移动,故v正>v逆,故A错误;
B、曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度,平衡向逆反应方向移动,故该反应正反应是放热反应,故B正确;
C、曲线上的点都是平衡点,B点的温度低于C的温度,温度越高,反应速率越快,则vB<vC,故C正确;
D、恒温恒压下向平衡体系中通入氦气,容器的体积增大,相当于减小压强,平衡向气体体积增大的方向移动,即平衡向左移动,故D正确;
答案选A。

 全程金卷系列答案
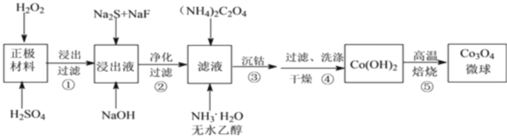
全程金卷系列答案【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是_________________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有____________气体产生,写出D中发生反应的离子方程式______________________。若去掉C,能否得出同样结论____________(填“是”或“否”) ,原因是____________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
___________________________ | ________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为________________________。
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式_______________。
【题目】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是
A. 上述反应中,正反应活化能大于逆反应活化能
B. 若升高温度,则k(正)增大,k(逆)减小
C. 在上述反应中,反应级数:m=2,n=1
D. 在一定温度下,NO、H2的浓度对正反应速率影响程度相同