题目内容
20.NaI是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图所示: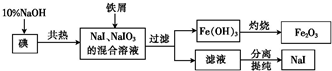
请回答下列问题:
(1)写出碘单质与10%NaOH溶液共热反应的离子方程式:3I2+6OH-=5I-+IO3-+3H2O.
(2)铁屑与NaIO3溶液充分反应可生成Fe(0H)3,此反应中氧化剂与还原剂的物质的量之比为1:2.
(3)NaIO3在一定条件下可转化为HIO4,25℃时,已知pH=2的HIO4溶液与pH=12的Na0H溶液等体积混合,所得混合溶液显酸性.则NaIO4溶液呈碱性填“酸性”、“中性”或“碱性”).
分析 由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,应的离子方程式为2Fe+IO3-+3H2O=2Fe(OH)3↓+I-,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,
(1)碘与NaOH溶液反应生成NaI、NaIO3;
(2)加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,Fe元素的化合价升高,I元素的化合价降低;
(3)25℃时已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合溶液显酸性,酸的物质的量大,说明高碘酸为弱酸,NaIO4溶液中高碘酸根离子水解显碱性.
解答 解:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,
(1)碘与NaOH溶液反应生成NaI、NaIO3,离子反应为3I2+6OH-=5I-+IO3-+3H2O,故答案为:3I2+6OH-=5I-+IO3-+3H2O;
(2)由2Fe+IO3-+3H2O=2Fe(OH)3↓+I-,Fe元素的化合价升高,I元素的化合价降低,氧化剂为NaIO3,还原剂为Fe,由反应可知,氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
(3)25℃时已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合溶液显酸性,说明高碘酸溶液中存在电离平衡,说明高碘酸为弱酸,NaIO4溶液中高碘酸根离子为弱酸根离子水解显碱性,
故答案为:碱性.
点评 本题考查制备实验,为高频考点,把握制备流程中发生的反应及操作为解答的关键,涉及氧化还原反应及pH的计算等,注重基础知识的考查,题目难度中等.

①钠与水反应时浮于水面且呈小球状游动 ②钠可以保存在四氯化碳中
③钠元素在自然界中只能以化合态形式存在 ④钠可从硫酸铜溶液中置换出铜
⑤金属钠只有还原性而没有氧化性.
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
| A. | (a+b)×63g | B. | (a+b)×169g | C. | [Vc-$\frac{9a+b}{3}$]mol | D. | (a+b)mol |
①0.02mol•L-1的H2A溶液
②0.02mol•L-1的NaHA溶液
③浓度均为0.02mol•L-1的Na2A溶液和NaHA的混合溶液
④0.02mol•L-1的Na2A溶液
下列关于上述四种溶液的说法不正确的是( )
| A. | 在②的溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| B. | 四种溶液中离子总数的关系:④>③>②>① | |
| C. | 四种溶液中c(H+)的关系:①>②>③>④ | |
| D. | 在①的溶液中:c(H+)=c(HA-)+c(A2-)+c(OH-) |
| A. | 使用有少量蒸馏水的容量瓶配制溶液 | |
| B. | NaOH溶解后未冷却到室温即转移至容量瓶 | |
| C. | 移液后烧杯未用蒸馏水洗涤 | |
| D. | 定容时俯视液面 |
 如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.
如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.