题目内容
【题目】分析如图,不能得出的结论是( ) 
A.H2与O2反应是放热反应
B.断开化学键要放出能量
C.化学反应伴随着物质变化和能量变化
D.2mol H2和1mol O2具有的总能量高于2mol H2O 的总能量
【答案】B
【解析】解:A.图像分析可知反应物能量高于生成物,反应为放热反应,故A正确; B.断裂化学键需要吸收能量,故B错误;
C.化学反应实质是旧键断裂新键形成,反应过程中一定伴随物质变化和能量变化,故C正确;
D.图像分析可知反应物能量高于生成物,2mol H2和1mol O2具有的总能量高于2mol H2O 的总能量,故D正确;
故选B.
图像分析可知氢气和氧气断裂化学键吸收能量,形成氢原子和氧原子,原子结合形成化学键放出热量生成水分子,化学反应实质是旧键断裂新键形成,反应过程中一定伴随能量变化,图中中反应物能量高于生成物,反应为放热反应,

【题目】三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:

已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
温度(℃) | 0 | 20 | 47 |
溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为 _________[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH![]() Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。

已知: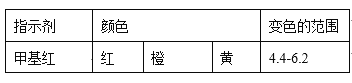
①当滴定到终点时,共需消耗NaOH溶液___mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______(填“偏大”、“偏小”或“不变”)
【题目】在2L密闭容器中进行反应:mX(g)+nY(g)pZ(g)+qQ(g),式中m、n、p、q为化学计量数.在0~3min内,各物质的量的变化如表所示:
物质 | X | Y | Z | Q |
时间 | ||||
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min内v(Q)=0.075molL﹣1min﹣1 , v(Z):v(Y)=1:2.
(1)2min内Z的反应速率v(Z)= .
(2)试确定以下物质的相关量:起始时n(Y)= , n(Q)= .
(3)方程式中m= , n= , p= , q= .
(4)对于该反应,能增大正反应速率的措施是 A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度.
【题目】表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①能使溴水褪色 | ①由C、H两 | ①由C、H、O三种元素组成 | ①相对分子质量 | ①由C、H、O三种元素组成 |
根据表中信息回答下列问题:
(1)A与水在一定条件下反应生成的物质C是(填名称);写出在一定条件下,A生成高分子化合物的化学方程式: .
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式 . 当n=时,这类有机物开始出现同分异构体.
(3)B具有的性质是(填序号). ①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
(4)写出由C氧化生成D的化学方程式: .
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为;其化学方程式为: .




