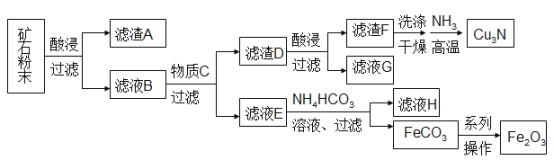
题目内容
【题目】在2L密闭容器中进行反应:mX(g)+nY(g)pZ(g)+qQ(g),式中m、n、p、q为化学计量数.在0~3min内,各物质的量的变化如表所示:
物质 | X | Y | Z | Q |
时间 | ||||
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min内v(Q)=0.075molL﹣1min﹣1 , v(Z):v(Y)=1:2.
(1)2min内Z的反应速率v(Z)= .
(2)试确定以下物质的相关量:起始时n(Y)= , n(Q)= .
(3)方程式中m= , n= , p= , q= .
(4)对于该反应,能增大正反应速率的措施是 A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度.
【答案】
(1)0.05mol?L﹣1?min﹣1
(2)2.3mol;3mol
(3)1;4;2;3
(4)C、D
【解析】解:(1)2min内Z的反应速率v(Z)= ![]() =
= ![]() molL﹣1min﹣1=0.05 molL﹣1min﹣1 , 所以答案是:0.05 molL﹣1min﹣1;(2)v(Z):v(Y)=1:2,则v(Y)=2v(Z)=2×0.05 molL﹣1min﹣1=0.1 molL﹣1min﹣1 , 参加反应的△n(Y)=v(Y)△tV=0.1mol/(L.min)×2L×2min=0.4mol,则反应初始n(Y)=2.7mol﹣0.4mol=2.3mol,2min内v(Q)=0.075molL﹣1min﹣1 , 参加反应的△n(Q)=v(Q)△tV=0.075mol/(L.min)×2L×2min=0.3mol,则反应初始n(Q)=2.7mol+0.3mol=3mol;所以答案是:2.3 mol;3 mol;(3)v(X)=
molL﹣1min﹣1=0.05 molL﹣1min﹣1 , 所以答案是:0.05 molL﹣1min﹣1;(2)v(Z):v(Y)=1:2,则v(Y)=2v(Z)=2×0.05 molL﹣1min﹣1=0.1 molL﹣1min﹣1 , 参加反应的△n(Y)=v(Y)△tV=0.1mol/(L.min)×2L×2min=0.4mol,则反应初始n(Y)=2.7mol﹣0.4mol=2.3mol,2min内v(Q)=0.075molL﹣1min﹣1 , 参加反应的△n(Q)=v(Q)△tV=0.075mol/(L.min)×2L×2min=0.3mol,则反应初始n(Q)=2.7mol+0.3mol=3mol;所以答案是:2.3 mol;3 mol;(3)v(X)= ![]() mol/(L.min)=0.025mol/(L.min),同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,所以m:n:p:q=0.025mol/(L.min):0.1 molL﹣1min﹣1:0.05 molL﹣1min﹣1:0.075molL﹣1min﹣1=1:4:2:3,所以答案是:1;4;2;3;(4)增大反应物浓度、升高温度、增大压强、加入催化剂等方法都能正反应速率,所以符合条件的只有CD,所以答案是:C D.
mol/(L.min)=0.025mol/(L.min),同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,所以m:n:p:q=0.025mol/(L.min):0.1 molL﹣1min﹣1:0.05 molL﹣1min﹣1:0.075molL﹣1min﹣1=1:4:2:3,所以答案是:1;4;2;3;(4)增大反应物浓度、升高温度、增大压强、加入催化剂等方法都能正反应速率,所以符合条件的只有CD,所以答案是:C D.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.