题目内容
【题目】A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子。
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为_____,F的价层电子排布式为_________________。
(2)B、C、D的电负性由大到小的顺序为_________(用元素符号填写),C与A形成的分子CA3的VSEPR模型为__________。
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是______________________________。
(4)以E、F的单质为电极,组成如图所示的装置,E极的电极反应式为_____________________________。

(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀溶解的离子方程式为___________________________。
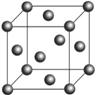
(6)F的晶胞结构(面心立方)如右图所示:已知两个最近的F的距离为acm,F的密度为__________g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)
【答案】 M 3d104s1 O>N>C 四面体 H2O中共价键的键能高于CH4中共价键的键能或非金属性O大于C,气态氢化物的稳定性H2O大于CH4 Al-3e-+4OH-=AlO2-+2H2O Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或 Cu(OH)2+4NH3H2O=[Cu(NH3) 4]2++2OH-+4H2O, ![]()
【解析】A的周期序数等于其主族序数,结合A、B、C、D、E、F是元素周期表中前四周期元素,可知A为H;B、D原子的L层中都有两个未成对电子,即2p2或2p4,则B为碳、D为O,根据核电荷数递增,可知C为N;E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1,则n=2,E为Al;F原子有四个能层,K、L、M全充满,最外层只有一个电子,则其电子排布式为[Ar]4s1,核电荷数为29,应为Cu;
(1)Al为第三周期ⅢA元素,则基态Al原子中,电子占据的最高能层符号为M,Cu的核电荷数为29,其电子排布式为[Ar]3d104s1,则价层电子排布式为3d104s1;
(2)非金属性越强,电负性越大,则C、N、O的电负性由大到小的顺序为O>N>C;氨气分子中氮价层电子对个数=σ键个数+孤电子对个数=3+![]() (5-3×1)=4,VSEPR模型为正四面体结构,含有一个孤电子对,所以其空间构型为三角锥形;
(5-3×1)=4,VSEPR模型为正四面体结构,含有一个孤电子对,所以其空间构型为三角锥形;
(3)非金属性越强,氢化物越稳定,O的非金属性比碳强,则CH4稳定性小于H2O;
(4)以Al、Cu和NaOH溶液组成原电池,因Al与NaOH之间存在自发的氧化还原反应,反应方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,可知Al为原电池的负极,电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(6)该晶胞为面心立方,晶胞中含有数目为8×![]() +6×
+6×![]() =4,则晶胞质量为
=4,则晶胞质量为![]() g,已知两个最近的Cu的距离为acm,可知晶胞的边长为
g,已知两个最近的Cu的距离为acm,可知晶胞的边长为![]() acm,该晶胞体积为(
acm,该晶胞体积为(![]() a)3cm3,则密度ρ=
a)3cm3,则密度ρ=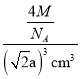 =
=![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案